Le glutamate est le principal neurotransmetteur excitateur dans le cerveau, étant le transmetteur utilisé par près de 8 synapses sur 10. Le glutamate est aussi très toxique pour les neurones s’il est présent en trop fortes concentrations, ce qui implique des systèmes sophistiqués pour bien contrôler la sensibilité des neurones à ce transmetteur. Pour ses effets excitateurs, le glutamate agit sur des récepteurs-canaux à action très rapide, mais il agit aussi sur des récepteurs modulateurs couplés à des voies de transduction intracellulaire via les protéines G. Ces derniers, appelés récepteurs métabotropiques du glutamate, ou mGluRs, jouent des rôles importants dans le contrôle de nombreuses synapses, et sont là pour leur permettre de s’adapter au glutamate présent dans l’espace extracellulaire.
Il existe 19 récepteurs mGlu, 8 constitués de 2 sous-unités identiques, et 11 constitués de deux sous-unités différentes. Bien qu’étudiés depuis plus de 30 ans, et identifiés comme des cibles potentielles de nouveaux médicaments, les mécanismes qui contrôlent leur présence à la surface des neurones restent peu connus. Pourtant, connaître la dynamique de ces récepteurs, leur internalisation, et leur recyclage, est essentiel pour estimer les effets de composés qui ciblent ces récepteurs dans le cerveau.
Marta Cimadevila, sous la direction conjointe de Jean-Philippe Pin et Laurent Prézeau, dans l’équipe « Neurorécepteurs, dynamique et fonction » dirigée par Philippe Rondard, a étudié l’internalisation et le recyclage de pratiquement tous les récepteurs mGlu. Son étude a utilisé une technologie innovante développée par la société Revvity/Cisbio, qui permet de suivre en direct l’internalisation des récepteurs de surface. Utilisée dans des cellules contrôles ou délétée de partenaires connus pour contrôler l’internalisation des récepteurs couplés aux protéines G, Marta a fait des observations surprenantes. Tout d’abord, elle a observé que tous les mGluRs s’internalisaient de façon constitutive et, contrairement à ce qui est observé avec les autres récepteurs couplés aux protéines G, ce processus nécessite une β-arrestine. Elle montre également, que seuls 5 mGluRs sur les 19 (1-1, 5-5, (et donc probablement 1-5), 3-3, ainsi que 2-3) voient leur internalisation largement augmenter par un agoniste, un mécanisme totalement indépendant des β-arrestines!
Plus de travail reste à faire pour comprendre les mécanismes impliqués et régulant ces processus, mais déjà on peut conclure que les mGluRs sont bien différents des autres GPCRs!
Ce travail vient d’être publié dans la revue Cell Reports.
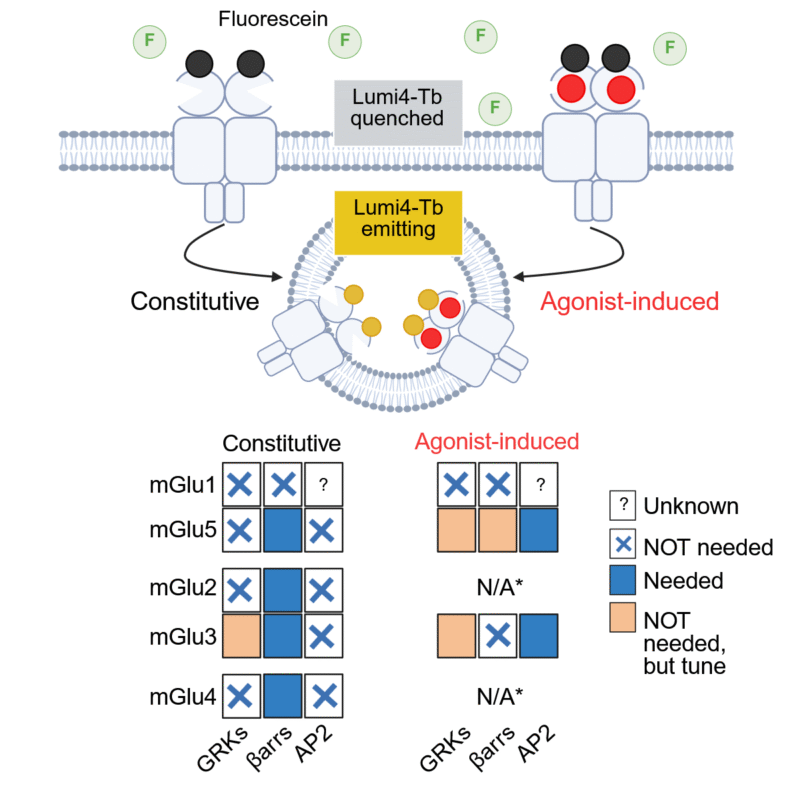
En haut, schéma du principe de la mesure de l’internalisation des récepteurs utilisée dans l’étude. Le fluorophore Tb étant quenché dans le milieu extracellulaire par un excès d’accepteur (fluorescéine), il ne fluoresce que lorsqu’il entre dans la cellule. En bas, résumé des récepteurs qui montrent une internalisation constitutive, et induite par un agoniste, et le rôle des GRK et des β-arrestines.


