Les récepteurs membranaires situés à la surface de toutes les cellules sont là pour permettre à ces dernières de réagir à l’arrivée de messagers. Parmi les récepteurs, ceux qui activent les protéines G intracellulaires (ou RCPGs) sont les plus nombreux. Ils représentent 3% de nos gènes codants et sont la cible d’un tiers des médicaments. Leur activité est donc finement régulée, et leur sur-activation conduit souvent à leur entrée dans la cellule, limitant l’action des messagers extracellulaires, et pouvant aussi conduire le récepteur internalisé à générer de nouveaux signaux à l’intérieur de la cellule.
Le mécanisme le plus courant conduisant à l’internalisation des RCPGs implique leur phosphorylation par des kinases spécifiques, les GRK, qui permet le recrutement d’une β-arrestine, cette dernière s’associant au complexe AP2 pour l’adressage du récepteur vers les puits recouverts de clathrine.
En analysant les propriétés d’internalisation de 60 RCPGs, Junke Liu dans l’équipe « Neurorécepteurs, dynamique et fonctions » animée par Philippe Rondard à l’IGF, en collaboration avec Revvity, Magalie Ravier (co-animatrice avec Eric Renard de l’équipe « Thérapeutiques innovantes pour le diabète » à l’IGF), Anne Goupil de Dassault Système, et le groupe de Carsten Hoffmann en Allemagne, montre que beaucoup d’entre eux internalisent même en absence de β-arrestines. Parmi eux, le récepteur du GLP-1, une hormone qui joue un rôle-clé dans le métabolisme, si bien que les activateurs de ce récepteur, initialement développés pour le diabète de type 2, sont maintenant largement utilisés pour lutter contre « l’épidémie » d’obésité. L’étude montre que le GLP-1R peut internaliser selon deux voies distinctes, l’une étant totalement indépendante des β-arrestines et implique une interaction directe du complexe AP2 avec le récepteur. La deuxième voie est, quant à elle, plus classique. Mais pourquoi deux mécanismes d’internalisation ? A cette étape des travaux, on ne peut que spéculer. Il est possible que les deux mécanismes soient impliqués dans des conditions différentes à identifier. Surtout, il est possible que le récepteur se retrouve dans des vésicules intracellulaires différentes permettant ou non, la signalisation intracellulaire du récepteur, son recyclage ou sa dégradation.
Ce travail montre combien chaque RCPG est unique, et combien il est important d’aller à l’encontre des dogmes.
Ce travail vient d’être publié dans la revue Nature Communications.
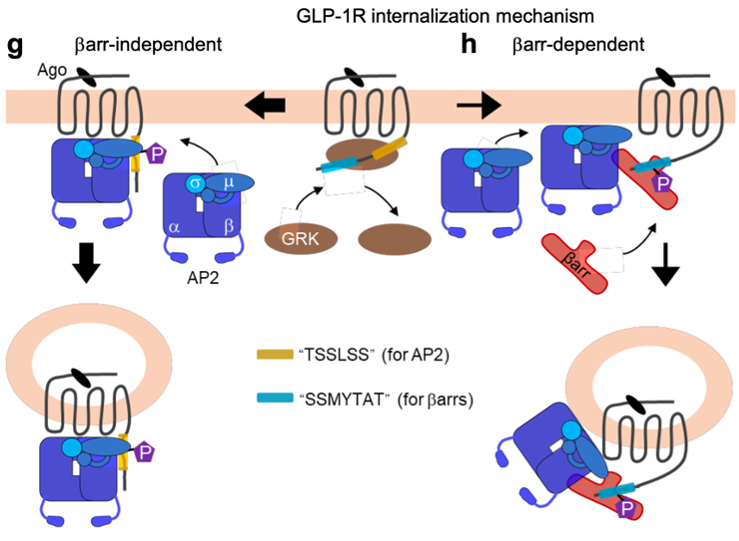
Représentation schématique des deux voies d’internalisation du récepteur du GLP-1. A gauche, l’interaction directe du récepteur avec le complexe AP2, conduit à une internalisation indépendante des β-arrestines. A droite, le mécanisme plus classique impliquant les GRK, le recrutement des β-arrestines puis leur association à AP2 pour conduire le récepteur vers les puits recouverts de clathrine.


