Équipe Philippe MARIN
Neuroprotéomique et signalisation des pathologies cérébrales
Projet HYDRA – Homéostasie et dérèglements physiologiques dans la maladie d’Alzheimer
RESPONSABLE

Personnel IGF impliqué
Geoffrey CANET
CRCN, CNRS
Carine BÉCAMEL
PU, UM
Sylvie CLAEYSEN
CRHC, Inserm
Marie-Laure PARMENTIER
DR2, Inserm
Charleine ZUSSY
Chercheur CDD, UM
Maëlle COLLADANT
Doctorante, Inserm
Magalie MATHIAS
IE CDD, UM
Etienne AUDINAT
DR1, CNRS
Cyril GOUDET
DR2, CNRS
Nicolas MARCHI
CRCN, CNRS
Jérémie NAUDÉ
CRCN, CNRS
Tristan MOUJELIL-LEGAGNEUR
IE CDD, Inserm

L’objectif général d’HYDRA est de caractériser l’impact de perturbations exogènes (telles que le stress chronique, l’épilepsie, les variations de températures…) sur la physiopathologie de la maladie d’Alzheimer (MA), mais aussi de développer des stratégies thérapeutiques innovantes (telles que l’utilisation de modulateurs sélectifs des récepteurs aux glucocorticoïdes, l’utilisation de molécules multi-cibles, la photopharmacologie sur le récepteur du glutamate mGlu5…) afin de contrecarrer le développement de la pathologie. Ce projet se divise selon 4 axes :
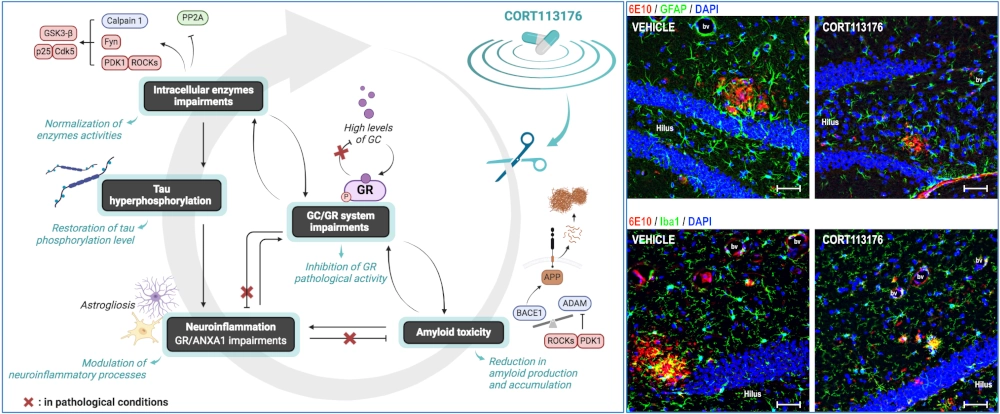
Stress, Glucocorticoïdes & MA
Dans le cas des formes sporadiques de la MA (plus de 99% des patients), même si les mécanismes sont encore mal connus, certains facteurs de risque ont été identifiés. Le principal de ces facteurs est le vieillissement, mais il est de plus en plus évident que certains évènements de la vie, tels que le stress chronique ou des pathologies liées au stress, comme la dépression, peuvent augmenter la probabilité de développer cette maladie neurodégénérative.
Ainsi, les principaux objectifs de ce projet préclinique basé sur des études in vivo sont :
- De confirmer que le stress chronique est un facteur de risque important dans le déclenchement et/ou le développement de la MA
- De décortiquer précisément le rôle joué par l’axe hypothalamo-hypophyso-surrénalien (HPA) (axe du stress), les glucocorticoïdes (GC) et leurs récepteurs (GR) dans l’étiologie de la MA
- D’évaluer le potentiel thérapeutique des modulateurs sélectifs des GR (en collaboration avec une société américaine « Corcept Therapeutics ») pour lutter contre les troubles liés au stress et ainsi limiter ou retarder le développement de la MA.
Principales publications
• Canet G et al. (2025) Br J Pharmacol, 182,1930-1956.
• Canet G et al. (2022) Neuroendocrinology, 112, 982-997.
• Canet G et al. (2020) FASEB J, 34, 1150-1168.
• Canet G et al. (2019) Front Aging Neurosci, 11, 269.
• Canet G et al. (2018) Front Neurosci, 12;739.
• Pineau F et al. (2016) Neurobiol Aging, 45, 109-22.
• Brureau A et al. (2013) Neurobiol Aging, 34, 1426-1439.
Financements
• 2019 – MUSE – Explore#2 – Coordinateur
• 2017-2018 – France Alzheimer – Projet GrAlz – Coordinateur
Collaborations
• Hazel Hunt (Menlo Park, USA)
• Onno Meijer (Leiden, Pays-Bas)
• Emmanuel Planel (Québec, Canada)
Alumni
• Mathieu Vitalis (IE UM, 2020-2024)
• Célia Hernandez (Doctorat, 2018-2020)
• Geoffrey Canet (Doctorat, 2016-2020)
• Anthony Brureau (Doctorat, 2007-2010)
• Charleine Zussy (Doctorat, 2006-2009)
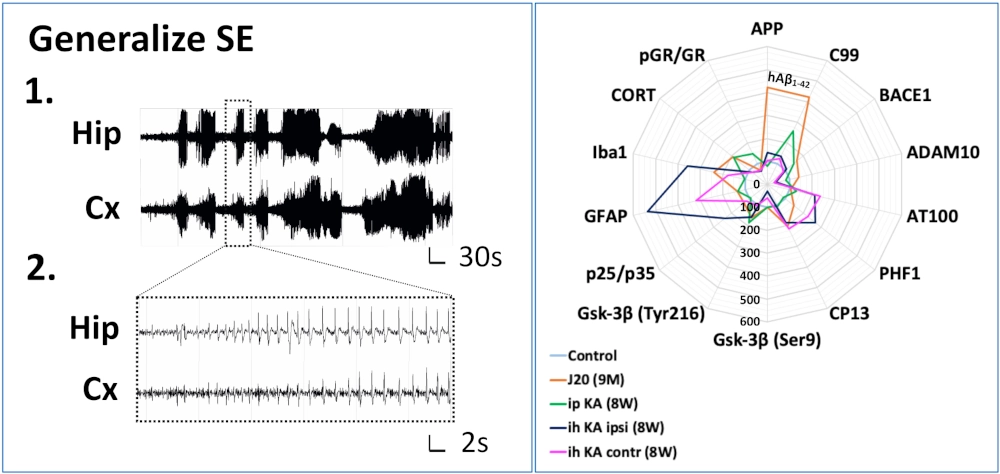
Épilepsie & MA
Un certain nombre d’études épidémiologiques ont montré que l’épilepsie semblait avoir un impact sur le déclenchement et/ou le développement de certaines maladies neurodégénératives, en particulier la MA, et à ce titre pourrait être considérée comme un facteur de risque. Ce facteur de risque pourrait être plus ou moins important en fonction de l’âge de survenue de la première crise épileptique. Nous avons donc réalisé des d’expériences préliminaires sur de jeunes animaux, qui nous ont permis de montrer sur 2 modèles murins de l’épilepsie (injection intra-hippocampique et injection intrapéritonéale de kaïnate) l’induction à long terme de marqueurs caractéristiques de la MA et d’identifier des voies communes à ces 2 pathologies.
L’objectif de ce projet est d’évaluer l’impact de l’âge de survenue d’une crise unique généralisée sur des animaux de différents âges et présentant ou non un phénotype de type Alzheimer (souris transgénique J20 vs. souris WT) et d’évaluer le potentiel thérapeutique des modulateurs sélectifs des GR afin de prévenir les processus neuroinflammatoires associés à l’épilepsie.
Principales publications
• Janvier A et al. (2025) Neurobiol Dis 217, 107177.
• Cresto N et al. (2025) Trends Mol Med, 31, 535-547.
• Canet G et al. (2022) Epilepsia, 63, 919-935.
• Zub E et al. (2019) FASEB J, 33, 13998-14009.
Financements
• 2022-2026 – ANR – Projet EpiNeurAge – Co-coordinateur
Collaborations
• Emmanuel Planel (Québec, Canada)
Alumni
• Mathieu Vitalis (IE UM, 2020-2024)
• Célia Hernandez (Doctorat, 2018-2020)
• Geoffrey Canet (Doctorat, 2016-2020)
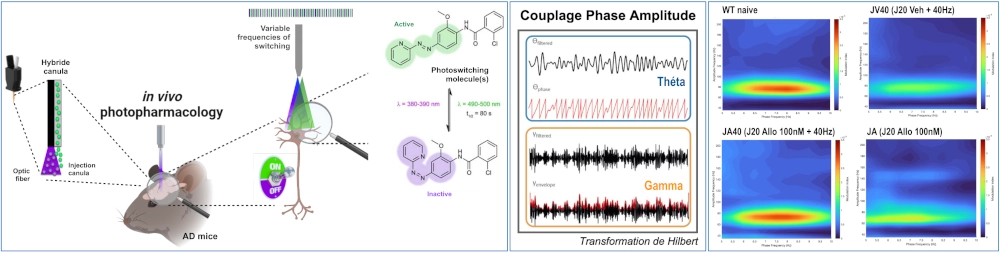
Activité neuronale oscillatoire, mGlu5 & MA
Le fonctionnement cérébral se caractérise par une activité neuronale oscillatoire qui est impliquée dans de nombreuses fonctions cérébrales telles que la mémoire ou le sommeil. Très récemment, la MA a été conceptualisée comme une « oscillopathie ». En effet, de plus en plus d’études chez des patients atteints de la MA, mais aussi sur des modèles animaux, font état d’une altération importante de l’activité oscillatoire des neurones. Ces altérations survenant sur une large gamme de fréquences, pourraient être à l’origine des déficits de mémoire, des troubles du sommeil, et contribueraient aux déficits de la clairance cérébrale des peptides β-amyloïdes (Aβ), favorisant ainsi son accumulation dans le cerveau.
Un des principaux neurotransmetteurs impliqués dans ces phénomènes oscillatoires et qui est fortement perturbé dans la MA, est le glutamate. C’est pourquoi dans ce projet nous nous sommes focalisés plus particulièrement sur les neurones glutamatergiques de l’hippocampe.
La photopharmacologie est une nouvelle stratégie expérimentale qui permet, grâce à la lumière, de contrôler des systèmes de modulation endogènes tels que les récepteurs métabotropiques glutamatergiques (mGluR). Ainsi, notre objectif est d’utiliser des ligands « photoswitchables » des mGluR pour moduler in vivo l’activité oscillatoire des neurones hippocampiques dans des modèles murins de la MA et au final, de contrecarrer les déficits mnésiques et métaboliques associés à la pathologie.
Principales publications
• Zussy C et al. (2025) BioRxiv (doi : 10.1101/2025.10.03.680254).
• Dumazer A et al. (2025) Biochem Pharmacol, 240, 117065.
• Notartomaso S et al. (2024) Elife 13.e94931.
• Dumazer A et al. (2024) ACS Chem Neurosci, 15, 645-655.
Financements
• 2020-2024 Université de Montpellier – MUSE AAP2020 – Projet GAiA – Coordinateur
• 2021-2024 Fondation Recherche Médicale (FRM) Maladies Neurodégénératives AAP2021 – Projet OPA – Coordinateur
• 2025 FRM Prématuration AAP2024 – Coordinateur
• 2025 Caixa Fundation (Spain) – Prématuration – Partenaire
• 2025-2029 PEPR LUMA – Projet HELIOPHORE – Partenaire
Collaborations
• Amadeu Llebaria (Barcelone, Espagne)
• Xavier Gomez-Santacana (Barcelone, Espagne)
• Emmanuel Planel (Québec, Canada)
• Romain HAUDECOEUR (Grenoble)
Alumni
• Mathieu Vitalis (IE UM, 2020-2024)
• Anaëlle Dumazer (Doctorat, 2020-2023)
Changements climatiques & MA
Dans un contexte de changement climatique et plus globalement de crise environnementale, l’exposition de la population aux risques environnementaux augmente, qu’il s’agisse d’une exposition directe (évènements climatiques extrêmes, incendies de forêts…) ou indirecte (informations sur les pandémies, les pollutions, les conséquences des sècheresses…), favorisant l’augmentation des niveaux d’anxiété́ au sein de la population et plus particulièrement d’éco-anxiété. Dans ce contexte, le projet Nexus CLIMAnX met en lien 4 expertises en sciences biologiques et épidémiologiques et en sciences humaines et sociales. Il étudiera l’impact sur la santé mentale (niveaux d’anxiété́, de dépression et, pour les populations humaines, niveaux d’éco-anxiété et du bien-être perçu en sus) d’un facteur physique (épisodes de canicule) vécu directement ainsi que d’autres facteurs d’exposition indirects.
Notre objectif dans ce projet multidisciplinaire sera d’étudier dans un modèle rongeur, l’impact à court et long-terme, d’une exposition répétée à des températures caniculaires sur le niveau d’anxiété́ et de dépression, le comportement social, le sommeil et les capacités cognitives, ainsi que les mécanismes biologiques adaptatifs mis en jeu, et les conséquences sur les processus neurodégénératifs, en particulier sur les principaux marqueurs de la MA.
Financements
• 2025-2029 – DOCTORAL NEXUS ExposUM 2025 – Projet CLIMAnx – Partenaire
Collaborations
• Manuel Bächtold et Laurent Brun (LIRDEFn Montpellier)
• Hélène Rey-Valette et Cécile Bazart (CEE-M, Montpellier)


