Équipe Emmanuel BOURINET
Dynamique des canaux calciques et nociception

Nous étudions les canaux calciques voltage-dépendants en faisant le pont entre leur fonctionnement moléculaire et leur impact dans la physiopathologie de la somatosensation. Cette approche de génomique fonctionnelle nous a permis d’acquérir une expertise reconnue dans le domaine de la recherche préclinique sur la douleur chronique et du sens du toucher.
Axe 1
Les questions abordées autour de rôle des canaux calciques à bas seuil d’activation concernent :
1) leur impact dans les neurones sensoriels mécanorécepteurs cutanés et viscéraux
2) leurs rôles dans les réseaux neuronaux spinaux pour l’intégration de l’information sensorielle
3) leur participation à l’excitabilité des circuits supraspinaux activés par les mécanorécepteurs
Ces questions sont abordées en utilisant de modèles précliniques douleurs proches de la clinique et en utilisant des tissus humains pour valider les travaux précliniques.
Axe 2
En parallèle, nous étudions les atteintes d’origine auto-immunes des neurones périphériques en se focalisant sur les nodopathies démyélinisantes. Cette approche est directement intégrée à la clinique en caractérisant des sérums de patients souffrant de ces pathologies douloureuses.
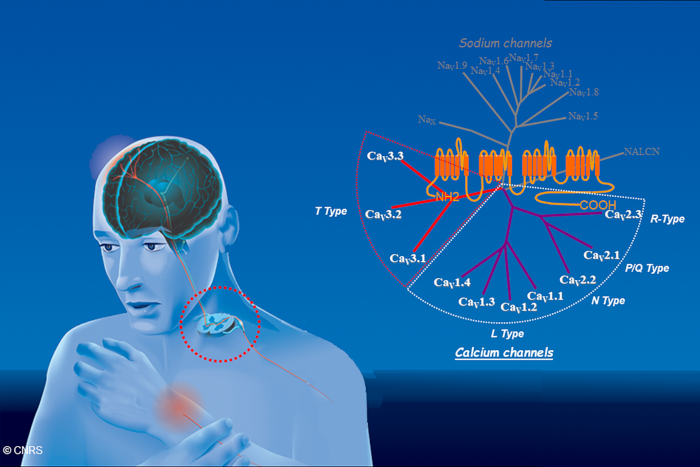
Diversité moléculaire des sous-unités canalaires des canaux calciques (CaV) appartenant à la super famille des canaux à 4 domaines transmembranaires. Notre activité de recherche vise à identifier le rôle de ces canaux dans les neurones sensoriels afférents primaires, et les neurones de la moelle épinières premiers maillons dans la perception de la douleur.

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48-
2000Habilitation à diriger les recherches (HDR) - Université de Montpellier I
-
1993Diplôme de doctorat (Ph.D.) - Université de Montpellier I
-
1989DEA Biomembranes - Université de Poitiers
-
1988Maitrise de Physiologie/Pharmacologie - Université de Poitiers
-
2015-Directeur de Recherche 1ère classe (DR1) CNRS
-
2005-Responsable d’équipe, Institut de Génomique Fonctionnelle - Montpellier - France
-
2005-2015Directeur de Recherche 2ème classe (DR2) CNRS
-
2002-2004Chargé de Recherche (CR1) CNRS, IGH - Montpellier - France
-
1996-2002Chargé de Recherche (CR2) CNRS, CRBM Montpellier - France
-
1993-1995Post doc, Snutch lab, The University of British Columbia - Vancouver - Canada
-
1991-1993Doctorant, Laboratoire du Pr Joël Nargeot, CNRS, CRBM - Montpellier - France
-
1988-1989DEA - Département Cardiovaculaire, Rhône Poulenc Rorer - Vitry sur Seine - France
-
2021-2026Président et de la section 25 du CoNRS (membre élu)
-
2016-2021Membre nommé de la section 25 du CoNRS
-
2007-2010Comité scientifique de l’Agence Nationale de la Recherche - CS16 Neurosciences
-
2011-2021Responsable commission équipement de l’Institut de Génomique Fonctionnelle
- Mon expérience en recherche est l’étude des canaux ionique et plus particulièrement les canaux calciques activés par le potentiel. Après avoir étudié la structure et la fonction de ces canaux, je recherche, avec mes collaborateurs, à comprendre leur impact dans la physiopathologie de la somatosensation en me concentrant sur les neurones sensoriels périphériques et les circuits spinaux en utilisant la génétique murine, l'électrophysiologie, la pharmacologie et le comportement dans des modèles précliniques de douleur chronique ainsi que dans l'étude du toucher social/affectif.
- Nous sommes convaincus que les résultats précliniques doivent être validés dans des tissus humains pour renforcer leur crédibilité dans des perspectives cliniques. Ainsi en collaboration avec des neurochirurgiens et la coordination des transplantations d'organes de l'hôpital de Montpellier nous appliquons nos explorations fonctionnelles moléculaires et ex vivo aux ganglions de la racine dorsale et aux tissus de la moelle épinière prélevés sur des donneurs d'organes. Ainsi, nous positionnons notre recherche sur une stratégie translationnelle inverse privilégiant les voies moléculaires conservées entre les modèles animaux et l'homme afin de maximiser nos chances de découvrir les mécanismes de la physiopathologie de la douleur et de la somatosensation au sens large.

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48-
2002Thèse de Doctorat d'Université - Université de Montpellier II
-
1998D.E.A. "Neurobiologie des processus de communication et d’intégration" - Université de Montpellier II
-
2004Chargé de Recherche CNRS, IGF - Montpellier - France
-
2009Médaille de bronze du CNRS
-
2003Prix de Thèse de la Société Française des Neurosciences
- Mes travaux concernent l'étude des canaux ioniques, en particulier la régulation des canaux calciques et leur rôles physiologiques.

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48-
2012-2013HDR en Neuroscience - Aix-Marseille Université - Marseille - France
-
1998-2001Thèse en Neuroscience - Université de St. Jérôme - Marseille - France
-
1996-1998Master en Neuroscience - Université de St. Jérôme, Marseille - France
-
1993-1996Licence - B.S. - Université de St. Jérôme - Marseille - France
-
2021-Chercheur statutaire CNRS DR2, IGF, CNRS - Montpellier - France
-
2019-2020Chercheur statutaire CNRS DR2, INM, INSERM - Montpellier - France
-
2018-2019Chercheur statutaire CNRS CRCN, INM - Montpellier - France
-
2009-2017Chercheur statutaire CNRS CR1, CRN2M, CNRS - Marseille - France
-
2005-2009Chercheur statutaire CNRS CR2, LNC, CNRS - Marseille - France
-
2004-2005Postdoctorat de la NMSS, The University of Pennsylvania - Philadelphia - USA
-
2002-2003Postdoctorat, The University of Pennsylvania - Philadelphia - USA
-
1998-2001Thèse, LNB, CNRS - Marseille - France
- Mon travail est axé sur la compréhension des mécanismes pathogènes conduisant à la perte de conduction dans les pathologies démyélinisantes humaines, ainsi que sur la compréhension de la fonction des canaux potassiques voltage-dépendants axonaux (Kv).
- Récemment, j'ai démontré que la neurofascine et la contactine-1, deux molécules d'adhésion cellulaire des nœuds de Ranvier, sont les cibles d'autoanticorps chez les patients atteints de polyneuropathie démyélinisante inflammatoire chronique. En utilisant des modèles animaux, j'ai montré que ces anticorps sont pathogènes et affectent le nœud de Ranvier. Ces deux protéines servent désormais de biomarqueurs pour cette pathologie et aident au choix thérapeutique. De plus, j'ai démontré que les canaux Kv (Kv7.2/3 et Kv3.1) sont localisés aux nœuds, et que les mutations humaines affectent leur trafic ou leur fonction.
- Mes objectifs à long terme sont de développer de nouvelles approches de diagnostic et de traitement des pathologies démyélinisantes, mais aussi de comprendre les mécanismes moléculaires qui orchestrent la formation et la stabilisation des nœuds de Ranvier.

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48-
1998Habilitation à diriger des recherches (HDR), Université de Pharmacie - Chatenay-Malabry - France
-
1991Doctorat, Université Pierre et Marie - Paris VI - France
-
2015-Chercheur Inserm, équipe "Dynamique des canaux calciques et nociception", IGF - Montpellier - France
-
2002-2015Chercheur Inserm, équipe "Endocrinologie moléculaire et cellulaire", IGF - Montpellier - France
-
1999-2001Chercheur Inserm & NH-MRC, Laboratoire de Rob Parton, Université de Queensland - Brisbane - Australie
-
1992-1999Chercheur Inserm, Laboratoire de Cardiologie Cellulaire et Moléculaire, Université de Pharmacie - Châtenay-Malabry - France
-
1988-1992Étudiant, Inserm U-241, Université Paris-Sud - Orsay France
-
2022-Responsable scientifique, Réseau des Animaleries et PCEA - Montpellier - France
-
2021-Membre du Comité de laboratoire, IGF - Montpellier - France
-
2020-Membre du Comité d'éthique régional, CEEA-LR - Montpellier - France
-
2014-Membre du comité de pilotage, animalerie IExplore - Montpellier - France
-
2014-Membre du comité d'organisation, Semaine du cerveau - Montpellier - France
- J'ai reçu une formation d'électrophysiologiste et j'ai exploité ces connaissances dans les domaines de la recherche cardiovasculaire, de la neuroendocrinologie et des neurosciences. Avec le temps, je me suis familiarisé avec un ensemble d'autres méthodes (biologie moléculaire, biologie cellulaire).
- J'étudie actuellement certains réseaux neuronaux de la moelle épinière et leur rôle dans la nociception et la douleur, tant chez la souris que chez l'homme.

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48

 IGF Sud 125
IGF Sud 125 04 34 35 92 48
04 34 35 92 48
- Yadav, K. J. E. Matson, L. Li, I. Hua, J. Petrescu, K. Kang, M. R. Alkaslasi, D. I. Lee, S. Hasan, A. Galuta, A. Dedek, S. Ameri, J. Parnell, M. M. Alshardan, F. A. Qumqumji, S. M. Alhamad, A. P. Wang, G. Poulen, N. Lonjon, F. Vachiery-Lahaye, P. Gaur, M. A. Nalls, Y. A. Qi, D. Maric, M. E. Ward, M. E. Hildebrand, P. F. Mery, E. Bourinet, L. Bauchet, E. C. Tsai, H. Phatnani, C. E. Le Pichon, V. Menon and A. J. Levine. A cellular taxonomy of the adult human spinal cord. Neuron 2023 111, 328-344 e7. 10.1016/j.neuron.2023.01.007, PMC10044516.
- Huzard, M. Martin, F. Maingret, J. Chemin, F. Jeanneteau, P. F. Mery, P. Fossat, E. Bourinet and A. Francois. The impact of C-tactile low-threshold mechanoreceptors on affective touch and social interactions in mice. Sci Adv 2022 8, eabo7566. 10.1126/sciadv.abo7566, PMC9242590.
- L. Fayad, G. Ourties, B. Le Gac, B. Jouffre, S. Lamoine, A. Fruquiere, S. Laffray, L. Gasmi, B. Cauli, C. Mallet, E. Bourinet, T. Bessaih, R. C. Lambert and N. Leresche. Centrally expressed Cav3.2 T-type calcium channel is critical for the initiation and maintenance of neuropathic pain. Elife 2022 11. 10.7554/eLife.79018, PMC9714965.
- Defaye, M. C. Iftinca, V. M. Gadotti, L. Basso, N. S. Abdullah, M. Cumenal, F. Agosti, A. Hassan, R. Flynn, J. Martin, V. Soubeyre, G. Poulen, N. Lonjon, F. Vachiery-Lahaye, L. Bauchet, P. F. Mery, E. Bourinet, G. W. Zamponi and C. Altier. The neuronal tyrosine kinase receptor ligand ALKAL2 mediates persistent pain. J Clin Invest 2022 132. 10.1172/JCI154317, PMC9197515.
- Beaulieu-Laroche, M. Christin, A. Donoghue, F. Agosti, N. Yousefpour, H. Petitjean, A. Davidova, C. Stanton, U. Khan, C. Dietz, E. Faure, T. Fatima, A. MacPherson, S. Mouchbahani-Constance, D. G. Bisson, L. Haglund, J. A. Ouellet, L. S. Stone, J. Samson, M. J. Smith, K. Ask, A. Ribeiro-da-Silva, R. Blunck, K. Poole, E. Bourinet and R. Sharif-Naeini. TACAN Is an Ion Channel Involved in Sensing Mechanical Pain. Cell 2020 180, 956-967 e17. 10.1016/j.cell.2020.01.033.
- Candelas, A. Reynders, M. Arango-Lievano, C. Neumayer, A. Fruquiere, E. Demes, J. Hamid, C. Lemmers, C. Bernat, A. Monteil, V. Compan, S. Laffray, P. Inquimbert, Y. Le Feuvre, G. W. Zamponi, A. Moqrich, E. Bourinet and P. F. Mery. Cav3.2 T-type calcium channels shape electrical firing in mouse Lamina II neurons. Sci Rep 2019 9, 3112. 10.1038/s41598-019-39703-3, PMC6395820.
- Francois, N. Schuetter, S. Laffray, J. Sanguesa, A. Pizzoccaro, S. Dubel, A. Mantilleri, J. Nargeot, J. Noel, J. N. Wood, A. Moqrich, O. Pongs and E. Bourinet. The Low-Threshold Calcium Channel Cav3.2 Determines Low-Threshold Mechanoreceptor Function. Cell Rep 2015 10, 370-382. 10.1016/j.celrep.2014.12.042.
- Garcia-Caballero, V. M. Gadotti, P. Stemkowski, N. Weiss, I. A. Souza, V. Hodgkinson, C. Bladen, L. Chen, J. Hamid, A. Pizzoccaro, M. Deage, A. Francois, E. Bourinet and G. W. Zamponi. The deubiquitinating enzyme USP5 modulates neuropathic and inflammatory pain by enhancing Cav3.2 channel activity. Neuron 2014 83, 1144-58. 10.1016/j.neuron.2014.07.036.
- Descoeur, V. Pereira, A. Pizzoccaro, A. Francois, B. Ling, V. Maffre, B. Couette, J. Busserolles, C. Courteix, J. Noel, M. Lazdunski, A. Eschalier, N. Authier and E. Bourinet. Oxaliplatin-induced cold hypersensitivity is due to remodelling of ion channel expression in nociceptors. EMBO Mol Med 2011 3, 266-78. 10.1002/emmm.201100134, PMC3377073.
- Bourinet, A. Alloui, A. Monteil, C. Barrere, B. Couette, O. Poirot, A. Pages, J. McRory, T. P. Snutch, A. Eschalier and J. Nargeot. Silencing of the Cav3.2 T-type calcium channel gene in sensory neurons demonstrates its major role in nociception. EMBO J 2005 24, 315-24. 10.1038/sj.emboj.7600515, PMC545807.




