Des mini-anticorps de lama ciblant des récepteurs du glutamate corrigent les déficits comportementaux dans des modèles pré-cliniques de la schizophrénie.
Les maladies mentales sont l’un des domaines de la médecine où les avancées ont été les plus rares au cours des 50 dernières années. Malgré quelques progrès récents pour le traitement de la dépression et la schizophrénie, l’exploration de nouvelles pistes thérapeutiques reste nécessaire. Dans le cas particulier de la schizophrénie, qui touche environ 1 % de la population et apparaît souvent chez les jeunes adultes, les traitements actuels ciblent essentiellement les systèmes de la dopamine et de la sérotonine. S’ils permettent de réduire certains symptômes, ils n’agissent que très peu sur les troubles cognitifs, c’est-à-dire les problèmes de concentration, de mémoire ou d’organisation, qui handicapent fortement la vie quotidienne des patients.
Depuis une vingtaine d’années, la recherche sur la schizophrénie s’intéresse particulièrement au glutamate, un messager chimique majeur du cerveau. Un type particulier de récepteurs du glutamate, appelés récepteurs métabotropes, semblent être une clé pour améliorer les troubles cognitifs. Aujourd’hui, la majorité des traitements en développement reposent sur de petites molécules chimiques. Bien que faciles à produire, celles-ci présentent plusieurs inconvénients : elles peuvent entraîner des effets indésirables et s’accumuler dans l’environnement. D’ailleurs, les essais cliniques portant sur des petites molécules ciblant les récepteurs du glutamate dans la schizophrénie ont échoué en raison d’effets secondaires ou d’un manque d’efficacité. Les chercheurs explorent désormais une alternative plus naturelle : les anticorps thérapeutiques. Ces protéines, produites naturellement par notre système immunitaire, sont très spécifiques, biodégradables, bien tolérées et conçues pour défendre notre organisme. Leur principale limitation est leur difficulté à atteindre le cerveau, protégé par une barrière biologique très sélective, la barrière hémato-encéphalique.
C’est dans ce contexte que les lamas jouent un rôle aussi surprenant qu’important. Ces animaux possèdent un type particulier d’anticorps à partir desquels il est possible de générer des mini-anticorps ou nanocorps environ dix fois plus petits que les anticorps classiques. Jusqu’à récemment, les scientifiques considéraient qu’à l’image des anticorps, les nanocorps ne pouvaient pas franchir la barrière du cerveau. Cette étude prouve le contraire.
À l’Institut de Génomique Fonctionnelle de Montpellier (IGF, CNRS, INSERM, Université de Montpellier), les Drs. Philippe Rondard, Julie Kniazeff et Jean-Philippe Pin (équipe « Neurorécepteurs, dynamique et fonctions ») ont conçu un nanocorps qui active de façon très spécifique le récepteur mGlu2, un récepteur métabotrope du glutamate. Ce travail a été réalisé en collaboration avec le Dr. Patrick Chames (CRCM, INSERM, CNRS, Université de Marseille), dont l’équipe a développé les nanocorps à partir de l’immunisation de lamas. Injecté par voie périphérique, ce nanocorps parvient à atteindre le cerveau et à corriger les troubles cognitifs dans deux modèles précliniques de la schizophrénie. Le premier est basé sur l’administration néonatale de phencyclidine, un psychotrope hallucinogène connu pour favoriser l’apparition de la schizophrénie, en collaboration avec les Drs. Carine Bécamel et Philippe Marin à l’IGF (Equipe « Neuroprotéomique et signalisation des pathologies cérébrales »). Le second modèle, d’origine génétique, a été développé par l’équipe de la Dr Amy Ramsey à l’Université de Toronto (Canada). Il correspond à des animaux présentant un comportement qui rappelle les signes cliniques de la schizophrénie associés à un déficit d’expression du récepteur NMDA, récepteur essentiel à la plasticité synaptique.
Les résultats obtenus avec ces deux modèles de la schizophrénie sont impressionnants : les fonctions cognitives des animaux traités s’améliorent nettement après une seule injection du nanocorps, avec un effet prolongé pendant plus d’une semaine. Un protocole de traitement sub-chronique de quatre semaines avec des doses diminuées confirme la persistance des bénéfices dans le temps. Des analyses complémentaires réalisées en collaboration avec le Dr Denis Servent (CEA, Saclay), ont révélé que les nanocorps injectés dans la zone abdominale parviennent à pénétrer dans le cerveau.
Ces travaux démontrent que les nanocorps constituent une alternative prometteuse par rapport aux approches actuelles : ils sont efficaces, ciblés, biodégradables, et surtout capables d’atteindre le cerveau. Contrairement aux petites molécules, ils limitent les effets secondaires et les impacts environnementaux ; et par rapport aux anticorps classiques, les nanocorps pénètrent plus facilement dans le cerveau.
Cette avancée marque un tournant majeur pour la neuropharmacologie et ouvre la voie à une nouvelle génération de traitements pour la schizophrénie, mais aussi potentiellement pour d’autres troubles psychiatriques. Trois brevets ont d’ores et déjà été déposés pour protéger cette innovation prometteuse.
Cette étude vient d’être publiée dans la revue Nature.
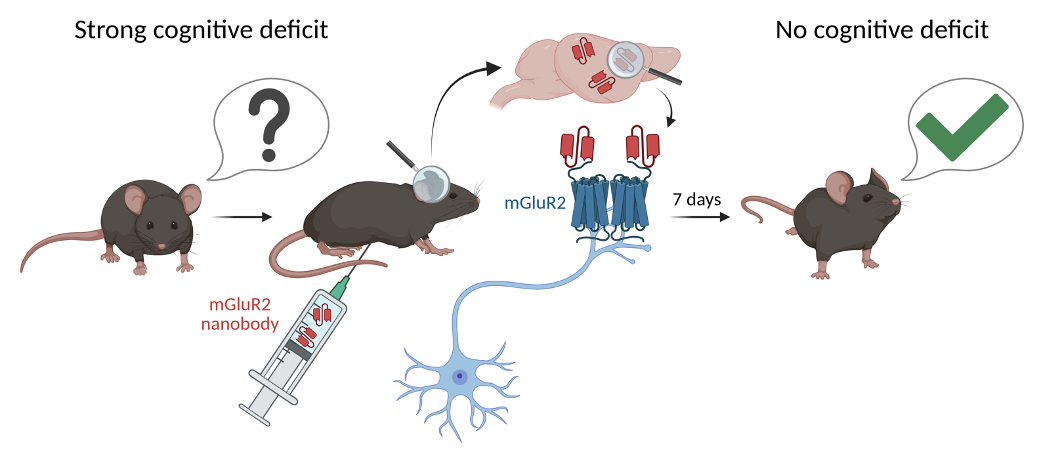
La schizophrénie est caractérisée par plusieurs phénotypes dont des troubles cognitifs qui ne sont pas corrigés par les traitements actuels. Pour pallier à ce manque, nous avons développé un nanocorps ciblant le récepteur mGlu qui pénètre dans le cerveau après administration dans la cavité abdominale et permet d’améliorer la cognition des animaux traités, un effet qui perdure jusqu’à 7 jours.


