Le principal neurotransmetteur, le glutamate, active des récepteurs canaux-ioniques pour générer des réponses excitatrices très rapides. Il y a plus de 40 ans, nos travaux menés à Montpellier ont montré que le glutamate active aussi des récepteurs à action modulatrice, via des récepteurs couplés aux protéines G (RCPG), les récepteurs métabotropiques du glutamate (mGuRs). Ces récepteurs sont apparus très tôt au cours de l’évolution, le glutamate étant déjà une molécule-message chez les bactéries et autres espèces unicellulaires. Ce système, apparu très tôt, a été à la base du développement des réseau complexes de connexions, à l’origine de systèmes d’analyse complexes comme les cerveaux. De ce fait, même si les mGluRs font partie de la grande famille des RCPG, les cibles principales des médicaments, leur mécanisme d’activation est très différent.
Contrairement à la plupart des RCPG, les mGluRs sont des dimères constitutifs, formés de deux sous-unités identiques ou différentes, et ont un grand domaine extracellulaire similaire aux protéines bactériennes du périplasme qui lient des acides aminés, des sucres ou des ions. Leur activation implique un mouvement entre les deux sous-unités, conduisant à un changement de conformation dans un des domaines membranaires, et à l’activation d’une protéine G. Nous avons montré, d’abord pour un récepteur similaire activé par le GABA, que l’activation de la protéine G résulte d’un mécanisme différent de celui utilisé par les autres RCPG, le changement de conformation du domaine membranaire étant différent, et la protéine G se fixant sur un site différent. Mais alors que la plupart des RCPG sont régulés par les β-arrestines, et même signalent via ces protéines, rien n’est connu sur les interactions fonctionnelles possibles entre les mGluRs et les β-arrestines, à l’exception du fait que ces dernières ne sont pas nécessaires à l’internalisation induite des mGluRs.
Dans le laboratoire commun entre l’équipe « Neurorécepteurs, dynamique et fonction » animée par Philippe Rondard à l’IGF et le laboratoire du Prof. Jianfeng Liu, à l’université HUST, à Wuhan en Chine, en collaboration avec les laboratoires de Zhenhua Shao et de Wei Yan, la structure du récepteur mGlu8 dans 5 états différents a été résolue, à savoir inactif sans ligand, inactif avec un antagoniste, lié à un agoniste et un modulateur allostérique positif avec et sans la protéine G, et avec le glutamate et la β-arrestine.
Plusieurs observations surprenantes ressortent de ce travail :
- l’agoniste sélectif de mGlu8, le DCPG, active pleinement le récepteur, bien qu’il ne ferme pas complètement le domaine de liaison, offrant par-là de multiples possibilités pour développer de nouveaux ligands spécifiques,
- les modulateurs allostériques positifs ne se fixent pas dans une poche du domaine membranaire, comme observé avec la plupart des modulateurs des mGluRs, mais à l’interface entre les deux sous-unités, entre les TM6,
- comme observé avec tous les autres récepteurs de cette famille, le récepteur activé est asymétrique, ce qui fait qu’une seule protéine G peut être activée,
- le récepteur peut aussi recruter la β-arrestine, mais dans une conformation originale, le récepteur étant symétrique, et dans un état proche de l’état inactif, permettant ainsi à deux β-arrestines de s’associer à ce dimère. Ceci conforte nos résultats précédents montrant que la β-arrestine est impliquée dans l’internalisation constitutive d’un récepteur inactif.
Ces nouvelles observations soulèvent de multiples questions concernant ces récepteurs mGluRs, en particulier le(s) rôle(s) que peuvent jouer les β-arrestines, sûrement bien différent(s) de ce qui est observé avec les autres RCPG.
Ce travail vient d’être publié dans la revue Molecular Cell.
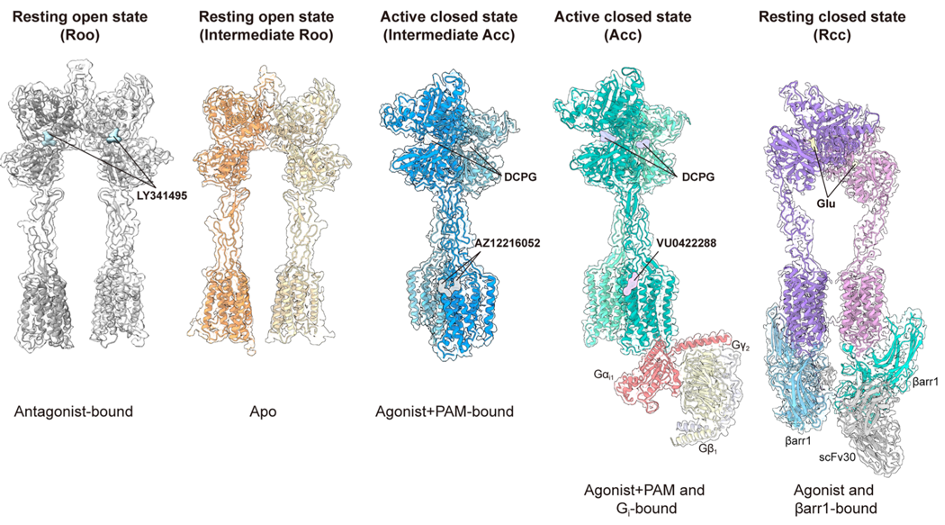
Représentations des cinq structures résolues de mGlu8 : i) en présence de l’antagoniste LY341495, ii) sans ligand (Apo), iii) liée à l’agoniste DCPG et au modulateur allostérique positif AZ12216052, iv) liée à l’agoniste DCPG, au modulateur allostérique positif VU0422288 et à la protéine Gi1 et v) liée au glutamate et à la β-arrestine1.


