STRESS HORMONES ET PLASTICITÉ
Département : Neurosciences
Thème de recherche
Pour plus d'informations, visitez le Site de l'équipe.
Une priorité de l’équipe est de clarifier comment les hormones impliquées dans la communication intercellulaire contrôlent le fonctionnement du cerveau et comment leurs dysfonctionnements peuvent conduire à des états pathologiques. Nous pratiquons des études longitudinales chez l’Homme et sur des modèles animaux des maladies de l’Homme pour prédire et modifier en toute sécurité des trajectoires pathologiques. C’est un challenge formidable qui dépend d’approches spécifiques pour capturer des observations multimodales avec une invasion minimale, en temps réel, notamment dans les pratiques de la microscopie intravitale, de l’électrophysiologie télémétrique, de l’inspection éthologique des comportements et de manipulations optogénétiques et chemogénétiques sur des modèles vigiles. Nous avons développé ces expertises depuis plusieurs années pour explorer les limites de plasticité des réseaux neuronaux à différentes échelles d’organisation (e.g. molécules, cellules, réseaux de neurones, organisme).
La diversité des réponses aux hormones de stress parmi les individus et entre organes, tissus and cellules est façonné par l’âge, le genre, la génétique, le métabolisme, et la qualité ou quantité d’exposition. Cependant, ces facteurs ne permettent pas d’expliquer l’hétérogénéité des réponses dans le cerveau, entre cellules de même lignage, ou dans le même environnement tissulaire, ou le même individu. Nous proposons d’investiguer comment la réponse au stress est continuellement révisée par la synchronisation de l’activité neuronale dans des réseaux du cerveau multiples et à grande échelle. Ceci se déroule au niveau moléculaire, cellulaire et comportemental par l’intégration des signaux issus des voies de signalisation dépendantes de l’activité et des hormones de stress, qui façonnent la diversité des réponses basées sur l’expérience d’évènements précédents. Une telle optimisation Bayesienne détermine l’adaptation ou la maladaptation aux demandes du cerveau, du corps et du monde extérieur.
Le 1er axe de recherche consiste à comprendre comment la diversité des réponses aux hormones glucocorticoïdes dans les réseaux neuronaux du cerveau contribuerait à maintenir une santé optimale, alors que l’homogénéité des réponses contribuerait au développement de pathophysiologies de maladies liées au stress, comme la dépression majeure et la résistance à des traitements thérapeutiques. Une hypothèse de travail sur laquelle nous travaillons est que le stress chronique accélère la maturation/vieillissement des systèmes neuronaux dans des régions du cerveau servant des fonctions proximales tout en supprimant le développement d’autres systèmes dans des centres contrôlant des fonctions utiles plus tard dans la vie. Autant la vulnérabilité que la résistance au risque de développer des troubles mentaux liés au stress dépendent de modifications du cerveau à de multiples échelles neuronales et sur le long terme. Ceci a une implication importante pour la prédiction des stratégies d’adaptation comportementales et l’efficacité des traitements.
Le 2e axe de recherche consiste à comprendre comment l’ontogénie des réseaux neuronaux du cerveau social de l’enfant particulièrement sensibles au stress, influence le comportement social plus tard dans la vie. Dès la naissance, une interaction entre gènes de susceptibilité au stress et des variations plus ou moins strictes dans l’environnement peu conduire au développement d’anxiétés sociales plus tard dans la vie, imposant un coût sociétal que l’on pourrait réduire si l’on pouvait le mesurer. A présent, des marqueurs quantitatifs pour le diagnostic précoce et l’évaluation du risque d’anxiétés sociales à long terme n’existent pas. Sans de tels marqueurs objectifs, le diagnostic, le suivi et l’ajustement de traitements se basent exclusivement sur des examens cliniques suboptimaux. Notre but est de développer des tests diagnostics fiables et sensible pour prédire l’efficacité des traitements qui peuvent prendre des mois voire des années pour se manifester.
Publications majeures
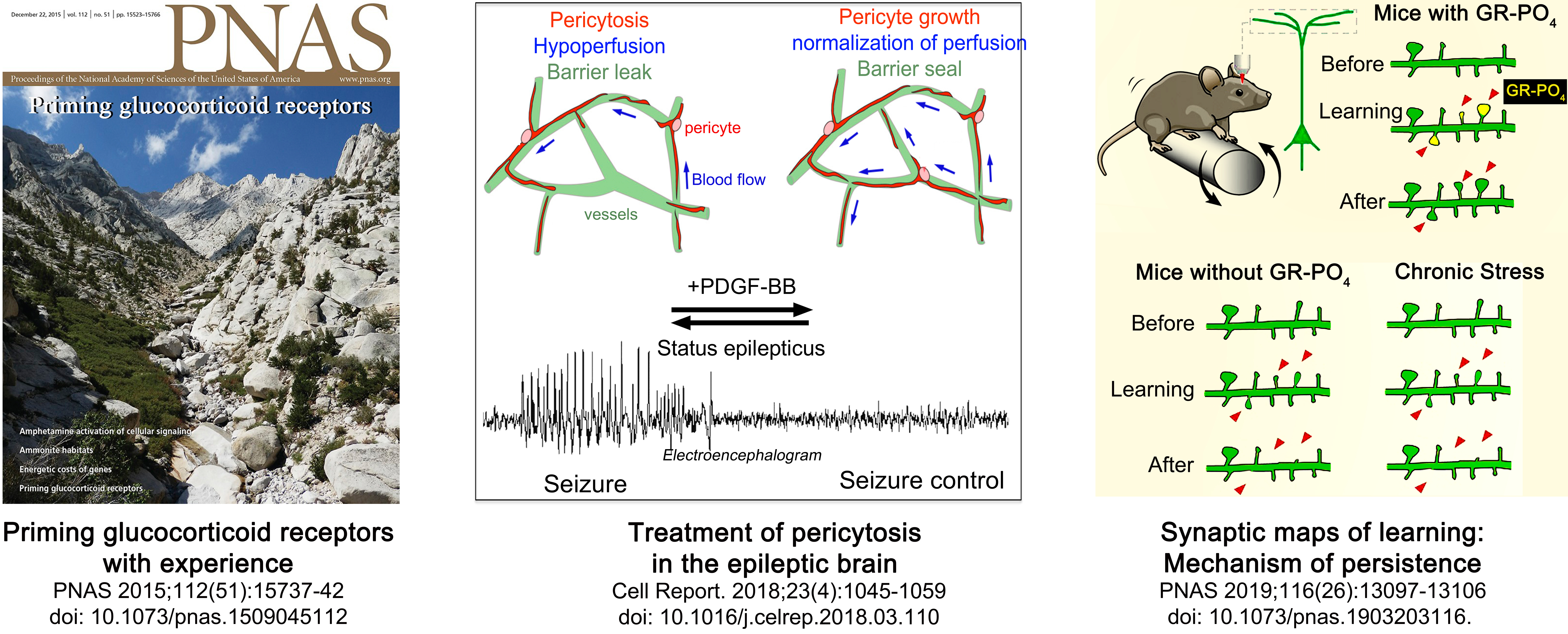
- Arango-Lievano M, Borie AM, Dromard Y, Murat M, Desarmenien MG, Garabedian MJ, Jeanneteau F. Persistence of learning-induced synapses depends on neurotrophic priming of glucocorticoid receptors. Proc Natl Acad Sci U S A. 2019 Jun 25;116(26):13097-13106. doi: 10.1073/pnas.1903203116
- Arango-Lievano M, Boussadia B, De Terdonck LDT, Gault C, Fontanaud P, Lafont C, Mollard P, Marchi N, Jeanneteau F. Topographic Reorganization of Cerebrovascular Mural Cells under Seizure Conditions. Cell Rep. 2018 Apr 24;23(4):1045-1059. doi: 10.1016/j.celrep.2018.03.110
- Jeanneteau F, Barrère C, Vos M, De Vries CJM, Rouillard C, Levesque D, Dromard Y, Moisan MP, Duric V, Franklin TC, Duman RS, Lewis DA, Ginsberg SD, Arango-Lievano M. The Stress-Induced Transcription Factor NR4A1 Adjusts Mitochondrial Function and Synapse Number in Prefrontal Cortex. J Neurosci. 2018 Feb 7;38(6):1335-1350. doi: 10.1523/JNEUROSCI.2793-17.2017
- Arango-Lievano M, Lambert WM, Bath KG, Garabedian MJ, Chao MV, Jeanneteau F. Neurotrophic-priming of glucocorticoid receptor signaling is essential for neuronal plasticity to stress and antidepressant treatment. Proc Natl Acad Sci U S A. 2015 Dec 22;112(51):15737-42. doi: 10.1073/pnas.1509045112
- Jeanneteau F, Lambert WM, Ismaili N, Bath KG, Lee FS, Garabedian MJ, Chao MV. BDNF and glucocorticoids regulate corticotrophin-releasing hormone (CRH) homeostasis in the hypothalamus. Proc Natl Acad Sci U S A. 2012 Jan 24;109(4):1305-10. doi: 10.1073/pnas.1114122109