NEW INSIGHTS INTO THE STRUCTURAL PHARMACOLOGY OF CALCIUM CHANNELS
UNE STRUCTURE CRYO-EM DU CANAL CALCIQUE CaV3.2 POUR MIEUX COMPRENDRE LES MODALITÉS DE LA SENSIBILITÉ PHARMACOLOGIQUE DES CANAUX CALCIQUES DE TYPE T
Les canaux ioniques sont la cible de nombreuses molécules d’intérêt thérapeutique. C’est le cas des canaux calciques de type T Cav3.2 : une cible prometteuse pour traiter entre autres certaines formes de douleur chronique et d’épilepsie, grâce au développement d’une nouvelle génération d’inhibiteurs plus sélectifs. Ces dernières années, notre compréhension du mécanisme d’action des modulateurs de canaux ioniques a été largement favorisée par la caractérisation structurale en cryo-EM de plusieurs de ces canaux ioniques. L’étude du groupe de Nieng Yan (Tsinguha University, Beijing) réalisée en collaboration avec Amaël Davakan et Philippe Lory (équipe "Canaux ioniques - Excitabilité neuronale et Canalopathies") présente la structure du canal Cav3.2 sous sa forme ‘apo’ ainsi que 4 structures obtenues en présence d’inhibiteurs sélectifs (TTA-P2, TTA-A2, ML-218 et ACT-709478). Ces données structurales identifient l’importance des interstices (‘fenestrations’) entre les 4 domaines transmembranaires par lesquels ces inhibiteurs rejoignent leur site de liaison se situant dans la cavité centrale du pore canalaire. Certaines drogues empruntent la ‘fenestration’ entre les domaines II et III, et c’est la ‘fenestration’ entre les domaines IV et I pour d’autres molécules. L’étude pointe également l’importance d’un résidu phénylalanine (Phe1007) dans la poche de liaison de ces inhibiteurs. Cette phénylalanine est parfaitement conservée entre les canaux de type T (Phe956 sur Cav3.1 et Phe854 sur Cav3.3). Dans son ensemble, cette étude apporte une vision structurale de la pharmacologie des canaux de type T en identifiant des déterminants moléculaires importants de la sélectivité et de l’affinité des bloqueurs. Ces travaux ouvrent la voie à la découverte de nouvelles molécules ciblant l’une ou l’autre des isoformes de Cav3, offrant ainsi de nouvelles perspectives thérapeutiques.
Cette étude vient d’être publiée dans le journal Cell Research.
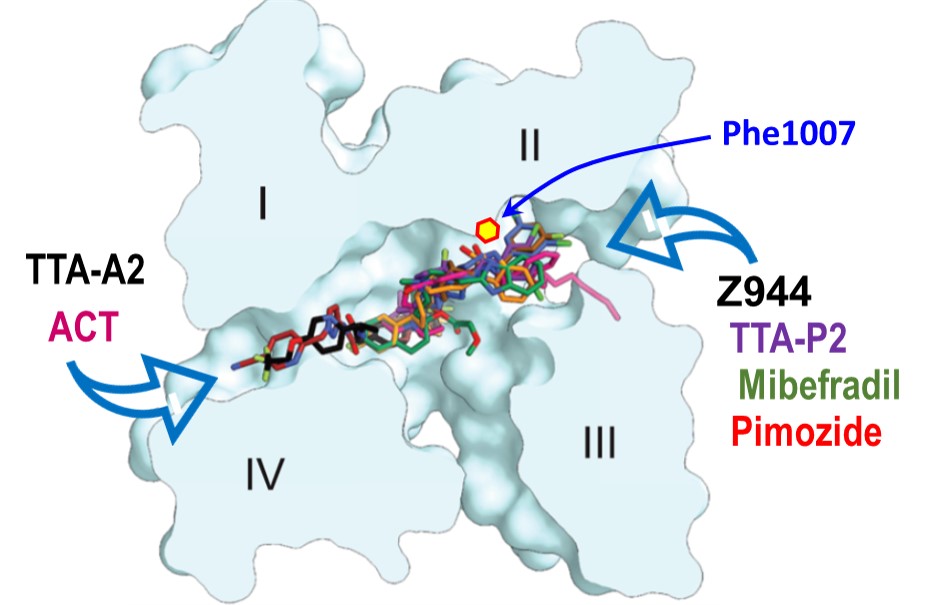
Cartographie structurale des sites de liaison des inhibiteurs des canaux Cav3 dans la cavité centrale du canal et leur positionnement respectif dans les fenestrations VI-I (TTA-A2 et ACT-709478) et II-III (Z944, TTA-P2, Mibefradil et Pimozide).
...................................................................................................................................................................................................................................................................................................................................................................
A CRYO-EM STRUCTURE OF THE CAV3.2 CALCIUM CHANNEL TO DECIPHER THE PHARMACOLOGICAL PROPERTIES OF T-TYPE CALCIUM CHANNELS
Ion channels are the target of numerous drugs of therapeutic interest. Such is the case of Cav3.2 T-type calcium channels: a promising target for the treatment of chronic pain and epilepsy conditions, among others, thanks to the development of a new generation of more selective T-type channel inhibitors. In recent years, our understanding of how channel modulators interact with ion channel proteins has been greatly enhanced by the availability of high-resolution structures thanks to the cryo-EM technology. The study by the Nieng Yan's group (Tsinguha University, Beijing) in collaboration with Amaël Davakan and Philippe Lory (team "Ion channels in neuronal excitability and diseases") presents the cryo-EM structures of the Cav3.2 channel both alone (apo), and in complex with 4 selective inhibitors (TTA-P2, TTA-A2, ML-218 and ACT-709478). These structural data underline the importance of the inter-domain fenestrations, by which these inhibitors reach their binding site in the central cavity of the channel pore. Some of these molecules use the fenestration F2 (between domains II and III), while other molecules use the fenestration F4 (between domains IV and I). The study also highlights the importance of a phenylalanine residue (Phe1007) in the binding pocket of these inhibitors. This phenylalanine is conserved between T-type channels (Phe956 in Cav3.1 and Phe854 in Cav3.3). Overall, this study provides new structural insight into the pharmacology of T-type channels, identifying important molecular determinants of the inhibitor selectivity and affinity. This work paves the way for the discovery of new drugs targeting Cav3 isoforms, opening up new therapeutic perspectives.
This study has just been published in Cell Research.

Structural mapping of Cav3 channel inhibitor binding sites in the central channel cavity and respective positioning of these molecules in fenestrations F4 : between domains VI-I (TTA-A2 and ACT-709478) and F2 : between domains II-III (Z944, TTA-P2, Mibefradil and Pimozide).