A NOVEL FUNCTION OF TUFT CELLS IN GUT DYSBIOSIS REVEALED
LES CELLULES TUFT À L’ORIGINE DE LA DYSBIOSE INTESTINALE
L’épithélium intestinal constitue la plus grande surface d’échanges avec le milieu extérieur et exerce un rôle fondamental de barrière afin de protéger l’organisme contre les pathogènes et agents infectieux présents dans la lumière intestinale. Le microbiote intestinal participe à cette fonction critique de barrière, et des altérations de sa composition (ou dysbiose) participent activement au développement et à la sévérité de diverses pathologies comme les maladies inflammatoires chroniques de l’intestin (MICI), les désordres métaboliques ou psychiatriques…
L'équipe animée par Philippe Jay à l'IGF vient d'identifier un nouveau mécanisme multi-étape d’initiation de la dysbiose qui met en jeu un crosstalk entre deux types cellulaires de l’épithélium, les cellules de Paneth qui contrôlent le microbiote via la sécrétion de peptides antimicrobiens, et les cellules tuft, des cellules sentinelles de l’épithélium dotées d’une fonction immunomodulatrice. Des défauts structurels et fonctionnels des cellules de Paneth, réminiscents de ceux observés chez des patients atteints de MICI ou obèses, provoquent des altérations modérées du microbiote et une amplification des espèces bactériennes qui produisent du succinate. L’augmentation du taux de succinate, normalement bas en conditions physiologiques, constitue un signal d’alarme. Les cellules tuft, qui expriment spécifiquement le récepteur au succinate, sont alors activées et induisent une réponse immunitaire de type 2 qui, en retour, aggrave les défauts des cellules de Paneth et provoque une dysbiose et une inflammation chronique.
Cette étude révèle une nouvelle fonction des cellules tuft comme promotrices de la dysbiose consécutive à des altérations des cellules de Paneth, et met en lumière le rôle jusqu’alors inconnu des cellules de Paneth dans le contrôle des bactéries productrices de succinate afin de prévenir l’activation permanente et délétère des cellules tuft. Ces travaux ouvrent la voie vers de nouvelles stratégies thérapeutiques ciblant l’activité de ces cellules.
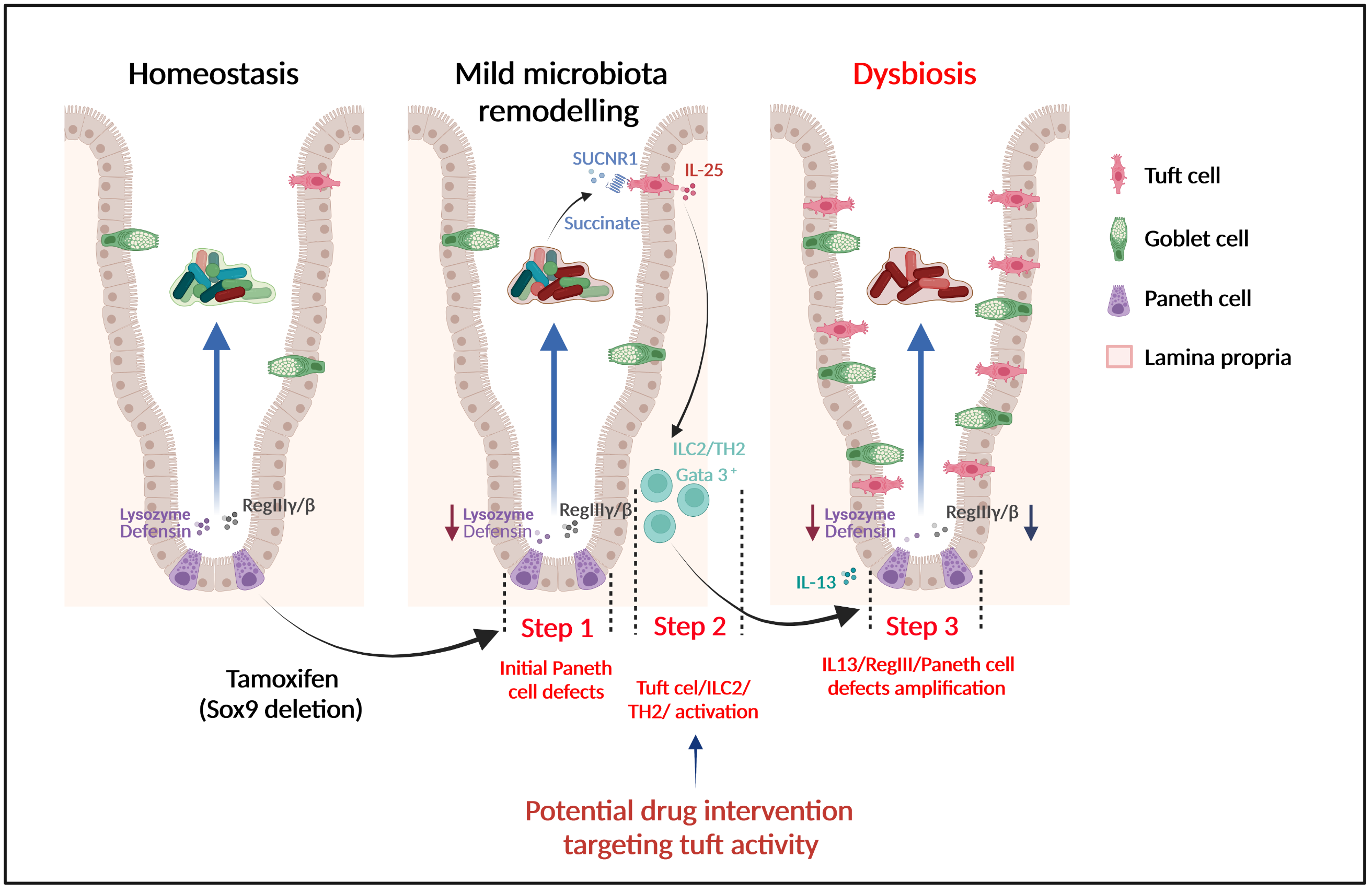
Mécanisme multi-étape d’établissement de la dysbiose mettant en jeu un circuit cellules de Paneth/succinate/cellules tuft/système immunitaire.
...................................................................................................................................................................................................................................................................................................................................................................
TUFT CELLS MEDIATE PANETH CELL-DRIVEN GUT DYSBIOSIS AND INFLAMMATION
The intestinal epithelium represents the largest exchange area with the external environment and constitutes a crucial barrier to protect the organism against pathogens and infectious agents found in the intestinal lumen. The intestinal microbiota plays a major role in this function, and alterations in its composition (dysbiosis) actively participate to the development and severity of multiple diseases such as inflammatory bowel disease (IBD), metabolic or psychiatric disorders…
The team headed by Philippe Jay at the IGF identified a novel multi-step mechanism for dysbiosis initiation via a cross talk between two epithelial cell types: Paneth cells, that control microbiota by secreting antimicrobial peptides, and tuft cells, key epithelial sentinels that regulate mucosal immunity in case of parasitic infection. Initial alterations in Paneth cell, as observed in IBD and obese patients, induce mild remodeling of microbiota, with amplification of succinate-producing species. The increase in succinate, normally low in physiological conditions, is a warning signal, which has the ability to specifically activate tuft cells through the succinate receptor. Tuft cells then induce a type 2 immune response that, in turn, exacerbates the Paneth cell defaults, thus promoting dysbiosis and chronic inflammation.
This study reveals a novel function of tuft cells in promoting dysbiosis following Paneth cell dysfunction, and highlights an unknown role of Paneth cells in controlling a balanced microbiota to prevent an inadequate and permanent tuft cell activation. Our findings open perspectives for therapies targeting tuft cell activity for a more effective management of dysbiosis-associated chronic diseases

Multi-step mechanism for establishment of dysbiosis and inflammation due to a Paneth cells/succinate/tuft cells/ immune cells circuit.