REV-ERBα : UN NOUVEAU "BAD BOY" POUR LES CELLULES β PANCRÉATIQUES
Le récepteur nucléaire REV-ERBα est impliqué dans l’altération de l’autophagie et de la survie des cellules β pancréatiques en conditions diabétogènes
La défaillance des cellules β pancréatiques dans le diabète de type 2 (DT2) est associée à une altération de l'autophagie, un mécanisme crucial pour le développement, la fonction et la survie des cellules β. Cependant, les mécanismes responsables de l’altération de l'autophagie des cellules β dans le DT2 restent méconnus. De récentes étudess études récentes ont montré que le répresseur transcriptionnel de l'horloge circadienne REV-ERBα était un nouveau régulateur de l'autophagie dans le cancer.
Dans l’étude menée par le Dr. Safia Costes (Equipe Dalle-Renard, Institut de Génomique Fonctionnelle, Montpellier) en collaboration avec l’équipe du Pr. Aleksey Matveyenko (Mayo Clinic, Rochester, MN, USA), il a été émis l’hypothèse que l'inhibition de l'autophagie médiée par REV-ERBα contribuerait à la défaillance des cellules β dans le DT2. Cette étude montre que les stress diabétogènes (tels que la glucotoxicité et l'inflammation médiée par les cytokines) augmentent l'expression de REV-ERBα dans les cellules β et altèrent l'autophagie et la survie de ces cellules.
Plus particulièrement, l'activation pharmacologique de REV-ERBα mime les effets des stress diabétogènes sur la cellule β en induisant l’altération du flux autophagique, de la survie et de la sécrétion d'insuline. A l’inverse, la modulation négative de REV-ERBα offre une protection partielle des cellules β face à l'inflammation et la glucotoxicité. Enfin, en utilisant des approches bioinformatiques, Brown et al. ont montré que l'augmentation de l'activité de REV-ERBα dans les îlots de patients atteints de DT2 est associée à une altération transcriptionnelle de l'autophagie et des voies de dégradation protéique.
En conclusion, cette étude révèle une relation de cause à effet jusqu'ici inexplorée entre REV-ERBα, l'inhibition de l'autophagie et la défaillance des cellules β dans le DT2.
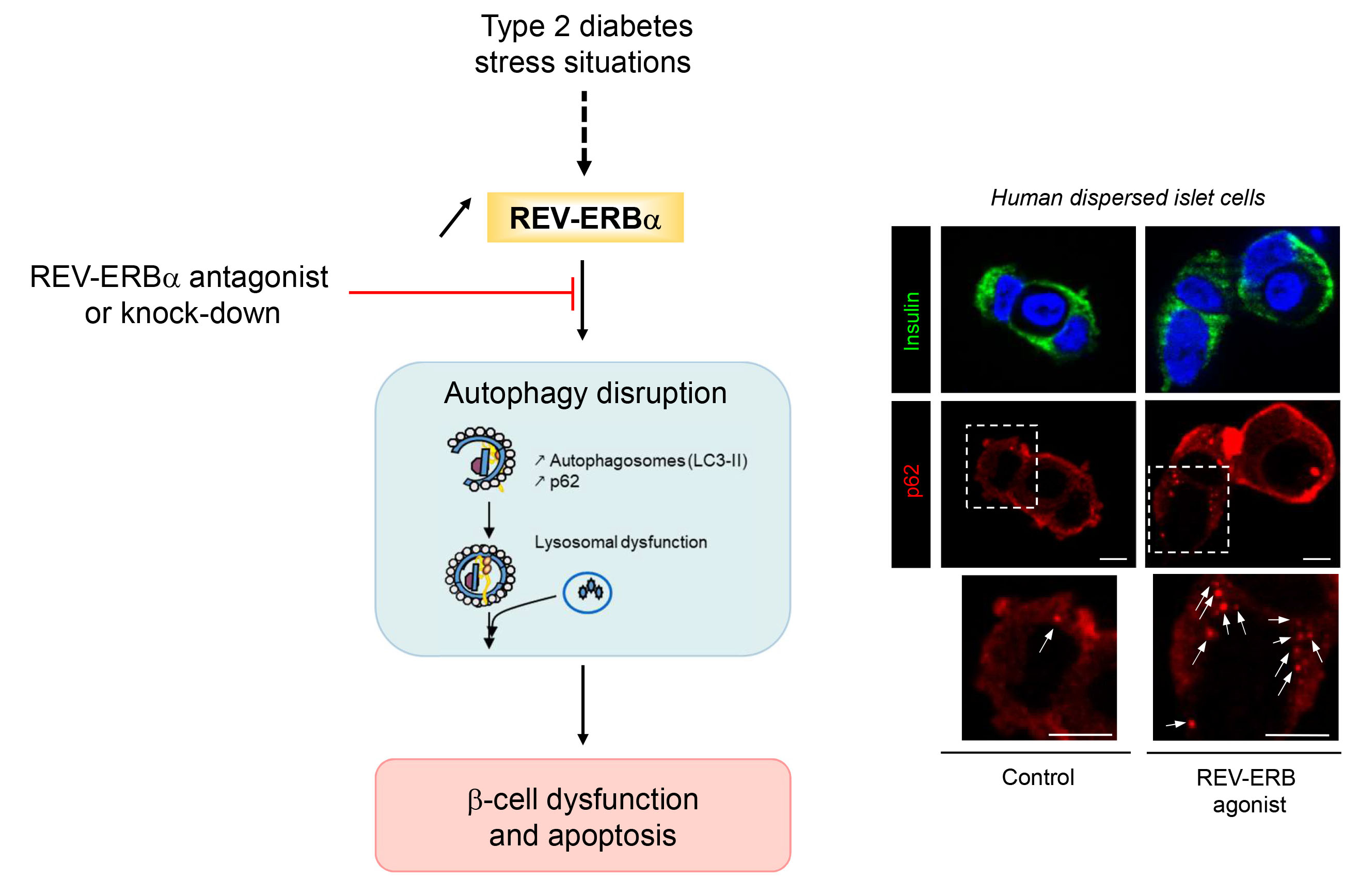
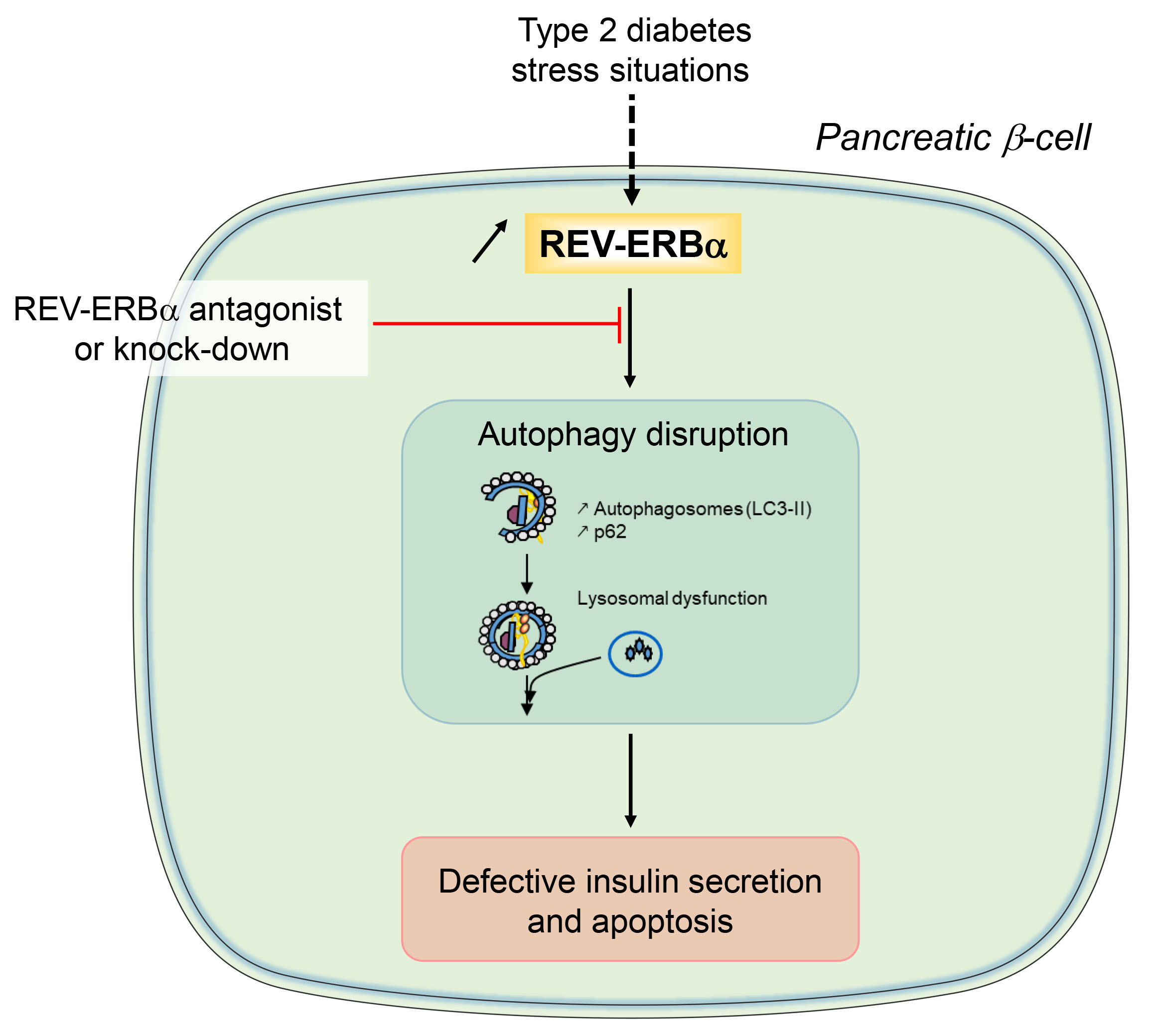
REV-ERBα in pancreatic β-cells.
On the right, p62-positive cytoplasmic inclusions (marker of autophagy disruption) are increased in human β-cells exposed to REV-ERBα agonist.
p62 protein levels were assessed by immunofluorescence (p62, red; insulin, green; nuclei, blue) in human dispersed islet cells.
The nuclear receptor REV-ERBα is implicated in the alteration of β-cell autophagy and survival under diabetogenic conditions. Brown MR, Laouteouet D, Delobel M, Villard O, Broca C, Bertrand G, Wojtusciszyn A, Dalle S, Ravier MA, Matveyenko AV, Costes S. Cell Death Dis. 2022 Apr 15;13(4):353.
...................................................................................................................................................................................................................................................................................................................................................................
REV-ERBα: A NEW "BAD BOY" FOR PANCREATIC β-CELLS
The nuclear receptor REV-ERBα is implicated in the alteration of β-cell autophagy and survival under diabetogenic conditions
Pancreatic β-cell failure in type 2 diabetes mellitus (T2DM) is associated with impaired regulation of autophagy which controls β-cell development, function, and survival through clearance of misfolded proteins and damaged organelles. However, the mechanisms responsible for defective autophagy in T2DM β-cells remain unknown.
Since recent studies identified circadian clock transcriptional repressor REV-ERBα as a novel regulator of autophagy in cancer, this study conducted by Dr. Safia Costes (Dalle-Renard Team, Institute of Functional Genomics, Montpellier) in collaboration with Pr. Aleksey Matveyenko (Mayo Clinic, Rochester, MN, USA) , set out to test whether REV-ERBα-mediated inhibition of autophagy contributes to the β-cell failure in T2DM. This study provides evidence that common diabetogenic stressors (e.g. glucotoxicity and cytokine-mediated inflammation) augment β-cell REV-ERBα expression and impair β-cell autophagy and survival. Notably, pharmacological activation of REV-ERBα was shown to phenocopy effects of diabetogenic stressors on the β-cell through inhibition of autophagic flux, survival, and insulin secretion. In contrast, negative modulation of REV-ERBα was shown to provide partial protection from inflammation and glucotoxicity-induced β-cell failure.
Finally, using bioinformatic approaches, Brown et al. provide further supporting evidence for augmented REV-ERBα activity in T2DM human islets associated with impaired transcriptional regulation of autophagy and protein degradation pathways.
In conclusion, this study reveals a previously unexplored causative relationship between REV-ERBα expression, inhibition of autophagy and β-cell failure in T2DM.