image de Jean-Louis Lovisa
POUSSE-TOI DE LÀ QUE JE M’Y METTE ! PROTÉINE G ET B-ARRESTINE ENTRENT EN COMPÉTITION
L’arginine vasopressine (AVP) est l’hormone antidiurétique qui régule une fonction vitale de notre organisme : l’équilibre hydrique. Elle agit au niveau du rein, plus précisément à la membrane plasmique des cellules principales du tube collecteur, segment distal du néphron. C’est par son interaction avec le récepteur V2 (V2R), protéine membranaire de la famille des récepteurs couplés aux protéines G (RCPGs), que cette hormone peptidique active une voie de signalisation cellulaire qui conduit à une relocalisation des canaux à eau, les aquaporines, et donc à la réabsorption de l’eau de l’urine vers le sang. Le couplage du récepteur V2 à la protéine Gs constitue une étape clé de cette voie de signalisation. Mais ce n’est pas tout. Le récepteur n’est pas « fidèle » à la protéine G car il interagit également avec les b-arrestines qui provoquent son internalisation/désensibilisation puis activent d’autres voies de signalisation impliquées en particulier au cours de la croissance et la différentiation cellulaire. Les deux partenaires canoniques de signalisation sont les deux facettes d’une régulation efficace de la fonction antidiurétique.
Alors, comment le récepteur V2 « choisit-il » entre la protéine G et la b-arrestine ? Un vrai dilemme Cornélien... Il y a un intérêt tout particulier à répondre à cette question puisque le développement de ligands du V2R sélectifs d’une voie ou d’une autre (ligands biaisés) présente un intérêt important pour améliorer l’efficacité des futures molécules thérapeutiques, tout en diminuant leurs effets indésirables.
Après avoir réussi à résoudre la structure du récepteur V2 en complexe avec l’AVP et la protéine Gs, l’équipe de Bernard Mouillac et Sébastien Granier à l’Institut de Génomique Fonctionnelle (IGF), en collaboration avec l’équipe de Patrick Bron au Centre de de Biologie Structurale (CBS) vient de déterminer la structure tridimensionnelle (3D) du V2R complexé à l’hormone naturelle AVP et à la b-arrestine1 par une approche de cryo-microscopie électronique (lien publication). C’est donc un travail 100% montpelliérain mais aussi une première française. Aujourd’hui, seules 5 structures de complexes de signalisation d’un RCPG couplé à une arrestine ont été décrites: celles impliquant la rhodopsine, le récepteur beta1-adrénergique, le récepteur M2 muscarinique de l’acétylcholine, le récepteur NTSR1 de la neurotensine et donc le récepteur V2 de l’AVP.
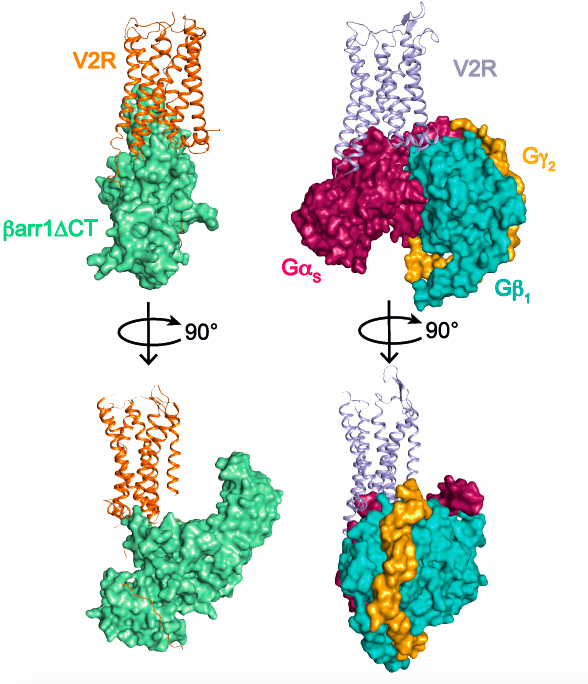
Cette approche de biologie structurale combinée à des approches de pharmacologie moléculaire et de modélisation/dynamique moléculaire, ont permis de déterminer l’architecture générale du complexe et en particulier de définir l’interface entre le récepteur et la b-arrestine (voir figure associée). Plusieurs surprises ont été révélées. Tout d’abord, l’orientation de la b-arrestine vis-à-vis du V2R est totalement atypique par rapport à celle des arrestines liées aux autres RCPGs. Ce positionnement met en avant le caractère très dynamique de ces complexes de signalisation et leur grande variabilité structurale malgré une conformation générale conservée. Ensuite, l’interface V2R-b-arrestine1 est originale car elle implique tous les domaines intracellulaires du récepteur. C’est donc une combinaison spécifique de la conformation du V2R et de la b-arrestine1 qui explique l’originalité de l’interaction. Enfin, la protéine Gs et la b-arrestine1 interagissent avec la même « cavité » intracellulaire du V2R et sont donc compétitives l’une par rapport à l’autre vis-à-vis de ce site de liaison. La comparaison des deux structures (voir figure associée) permet de comprendre comment la b-arrestine « arrête » le signal associé à la protéine G en prenant la place de celle-ci (pousse-toi de là que je m’y mette), phénomène à la base des processus d’internalisation et de désensibilisation du récepteur.
Le V2R est une cible thérapeutique majeure pour traiter les désordres du métabolisme de l’eau (hyponatrémie consécutive à une insuffisance cardiaque, hypertension, cirrhose du foie) et les troubles de la miction (incontinence). De plus, de nombreuses mutations du récepteur sont responsables de deux maladies génétiques rares présentant un tableau clinique inversé : 1/ le diabète insipide néphrogénique congénital (DINc) dû à des mutations « perte de fonction » associées à une incapacité des patients à concentrer leurs urines, 2/ le syndrome néphrogénique d’antidiurèse inappropriée (SNADI) lié à des mutations constitutivement actives caractérisé par une intoxication à l’eau et une hyponatrémie. Le V2R est également une cible primordiale pour traiter certaines formes de polykystose rénale, maladie beaucoup plus fréquente menant en général à une insuffisance rénale. A l’avenir, la connaissance complète des détails atomiques des différentes conformations du récepteur V2, aussi bien actives (en présence d’agonistes et des partenaires de signalisation) qu’inactives (en présence d’antagonistes) guidera le développement rationnel de nouvelles molécules thérapeutiques améliorées. Cette perspective de recherche est cruciale vis-à-vis de maladies difficiles à gérer et accablantes pour les patients.
Lien publication : Structure of the vasopressin hormone-V2 receptor-b-arrestin1 ternary complex.
J. Bous#, A. Fouillen#, H. Orcel, S. Trapani, X. Cong, S. Fontanel, J. Saint-Paul, J. Lai-Kee-Him, S. Urbach, N. Sibille, R. Sounier, S. Granier*, B. Mouillac*, P. Bron*.
#co-premiers auteurs *auteurs correspondants
Science Advances, 2022
Comparaison des complexes de signalisation du récepteur V2 impliquant la b-arrestine1 (à gauche) et la protéine Gs (à droite). Les trois sous-unités a, b et g de la protéine G sont représentées. Une version tronquée (barr1DCT) de la b-arrestine1 a été utilisée dans cette étude.
Comparison of V2 receptor signaling complexes involving b-arrestin1 (left) and Gs protein (right). The three subunits a, b and g of the G protein are represented. A truncated version (barr1DCT) of b-arrestin1 was used in this study.
........................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
GET OUT OF HERE, LET ME GET ON IT! THE G PROTEIN AND THE B-ARRESTIN COMPETE.
Arginine-vasopressin (AVP) is known as the antidiuretic hormone, and it regulates a vital function of our body: water homeostasis. It plays a role in the kidney at the basolateral membranes of the principal cells of the distal collecting duct of the nephron where it directly interacts with the V2 receptor subtype (V2R), which is a typical G protein-coupled receptor (RCPGs). Upon interaction, AVP activates a signaling pathway leading to fusion of aquaporine water channels to the apical membrane of the cells and consequently to water reabsorption from urine to blood. Coupling of the V2R to the Gs protein constitutes a first key step of the cellular response. But that’s not all! The receptor is not "faithful" to the G protein because it also interacts with b-arrestins which cause its internalization/desensitization and then activate other signaling pathways involved in particular during cell growth and differentiation. The two canonical signaling partners are two facets of effective regulation of antidiuretic function.
So how does the V2 receptor “choose” between G protein and b-arrestin? A real Cornelian dilemma… There is a particular interest in answering this question since the development of V2R ligands selective for one pathway or another (biased ligands) presents an important interest to improve the efficiency of future therapeutic molecules, while decreasing their side effects.
After solving the structure of the AVP-bound V2 receptor-Gs signaling complex, the team of Bernard Mouillac and Sébastien Granier at the Institute of Functional Genomics (IGF), in collaboration with the team of Patrick Bron at the Center for Structural Biology (CBS) has now determined the three-dimensional (3D) structure of the AVP bound V2R-b-arrestin1 complex using cryo-electron microscopy (publication link). It is therefore a work 100% done in Montpellier but also a French first. Today, only 5 structures of signaling complexes of a GPCR coupled to an arrestin have been described: those involving rhodopsin, the beta1-adrenergic receptor, the M2 muscarinic acetylcholine receptor, the NTSR1 receptor of neurotensin and therefore the AVP V2 receptor.
This structural biology approach combined with molecular pharmacology and modeling/molecular dynamics approaches, made it possible to determine the general architecture of the complex and in particular to define the interface between the receptor and beta-arrestin (see associated figure). Several surprises were revealed. First of all, the orientation of b-arrestin1 with respect to V2R is totally atypical compared to that of arrestins linked to other GPCRs. This positioning highlights the very dynamic character of these signaling complexes and their great structural variability despite a conserved general conformation. Then, the V2R-b-arrestin1 interface is original because it involves all the intracellular domains of the receptor. It is therefore a specific combination of the conformation of V2R and b-arrestin1 that explains the originality of the interaction. Finally, the Gs protein and b-arrestin1 interact with the same intracellular "cavity" of the V2R and are therefore competitive with each other for this binding site. The comparison of the two structures (see associated figure) makes it possible to understand how b-arrestin "stops" the signal associated with the G protein by taking its place (get out of here, let me get on it), a phenomenon responsible for internalization and desensitization of the receptor.
V2R is a major therapeutic target for treating water metabolism disorders (hyponatremia consecutive to heart failure, hypertension, liver cirrhosis) and voiding disorders (incontinence). In addition, numerous mutations of the receptor are responsible for two rare genetic diseases with opposite clinical outcomes: 1/ congenital nephrogenic diabetes insipidus (cNDI) due to "loss of function" mutations associated with an inability of the patients to concentrate their urine, 2/ nephrogenic syndrome of inappropriate antidiuresis (NSIAD) linked to constitutively active mutations associated to excessive water loading and hyponatremia. V2R is also an essential target for treating certain forms of polycystic kidney disease, a much more frequent disease generally leading to renal failure. In the future, the complete knowledge of the atomic details of the different conformations of the V2 receptor, both active (in the presence of agonists and signaling partners) and inactive (in the presence of antagonists) will guide the rational development of new molecules leading to improved therapies. This research perspective is crucial when dealing with diseases that are difficult to manage and overwhelming for patients.
Publication link: Structure of the vasopressin hormone-V2 receptor-b-arrestin1 ternary complex.
J. Bous#, A. Fouillen#, H. Orcel, S. Trapani, X. Cong, S. Fontanel, J. Saint-Paul, J. Lai-Kee-Him, S. Urbach, N. Sibille, R. Sounier, S. Granier*, B. Mouillac*, P. Bron*.
#these authors contributed equally to this work *corresponding authors
Science Advances, 2022