LE CALCIUM CELLULAIRE SCANDE LES HEURES ET LES SECONDES DE NOTRE HORLOGE INTERNE
Le calcium est un "homme à tout faire" dans nos cellules : il convertit les signaux de l'extérieur en messages internes, régule l'expression des gènes, ou active la sécrétion hormonale. Cette diversité d'actions du calcium repose sur un véritable code cellulaire, fondé sur la répétition de signaux calciques brefs (d'une centaine de millisecondes à quelques secondes), modulés en amplitude et/ou en fréquence. Une étude coordonnée par Xavier Bonnefont à l'IGF révèle que le code calcique pourrait recouvrir des échelles de temps plus inattendues.
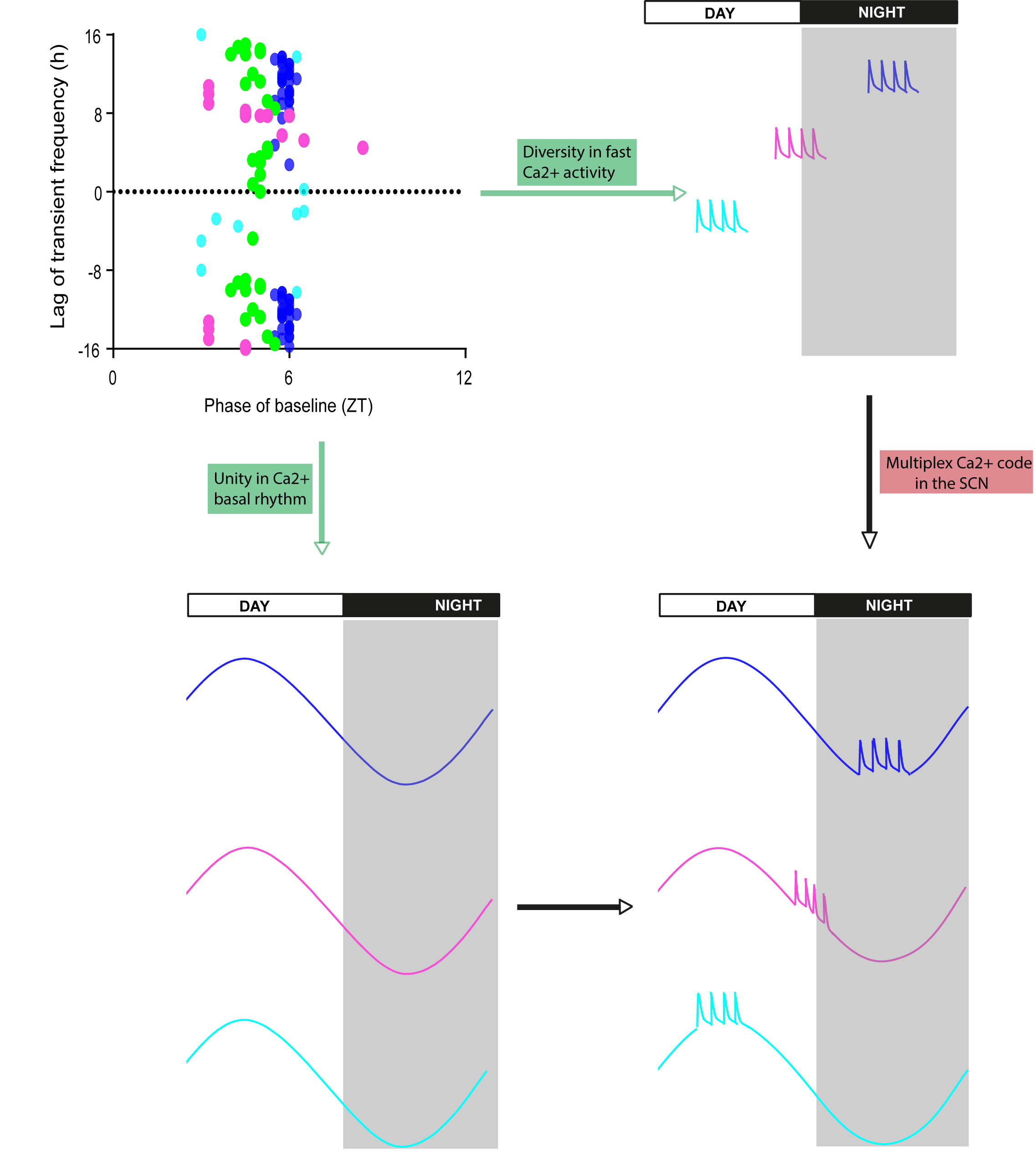
Au plus profond de notre cerveau, dans l'hypothalamus, les noyaux suprachiasmatiques (NSC) hébergent l'horloge interne qui synchronise nos rythmes biologiques avec le cycle jour-nuit. La concentration en calcium y est élevée pendant la journée, et basse pendant la nuit. Cependant, la localisation profonde des NSC a longtemps empêché d'étudier cette oscillation ultra-lente in vivo à l'échelle des cellules individuelles. De plus, sa relation avec les signaux calciques brefs, typiquement liés à l'activité neuronale restait indéterminée. Pour répondre à ces questions, les chercheurs de l'IGF ont utilisé une technique d'imagerie de pointe pour suivre le calcium cellulaire avec un microscope miniaturisé dans les NSC de souris libres de leurs mouvements. Cette approche montre que les signaux calciques rapides sont de petite amplitude dans les neurones des NSC, et se greffent sur l'oscillation journalière de la concentration basale en calcium. De façon remarquable, ces deux dynamiques calciques évoluent indépendamment l'une de l'autre au cours du cycle jour-nuit. L'oscillation lente de la concentration basale, coordonnée entre tous les neurones enregistrés, révèle l'unité de tempo essentielle pour la précision de notre horloge circadienne. Au contraire, les signaux rapides soulignent la diversité fonctionnelle de ces mêmes neurones, certains étant plutôt actifs le jour quand leur concentration en calcium est élevée, d'autres la nuit quand le niveau de calcium est bas. Cette imbrication d'oscillations coordonnées au fil des heures et indépendantes à l'échelle de la seconde enrichit le code calcique d'une multitude de combinaisons nouvelles dans les cellules horloges.
De façon plus générale, ce travail publié dans PNAS Nexus illustre comment le calcium permet d'individualiser des sous-ensembles fonctionnels dans à un réseau neuronal cohérent, à l'instar des joueurs d'une équipe sportive où chacun remplit une fonction spécifique tout en arborant le même maillot que ses coéquipiers.
...................................................................................................................................................................................................................................................................................................................................................................
CELLULAR CALCIUM SETS THE HOURS AND SECONDS OF OUR INTERNAL CLOCK
Calcium is a "jack of all trades" in our cells: it converts external signals into internal messages, regulates gene expression, or activates hormone secretion. Calcium fulfills such a plurality of actions through a genuine cell code, based on the recurrence of brief calcium signals (from a hundred milliseconds to a few seconds), modulated in amplitude and/or frequency. A study coordinated by Xavier Bonnefont at the IGF reveals that the calcium code may encompass a wider range of timescales.
Deep in our brain, in the hypothalamus, the suprachiasmatic nuclei (SCN) host the internal clock that paces our biological rhythms in tune with the day-night cycle. SCN neurons display high calcium levels during the day and low calcium levels at night. However, investigating this ultra-slow calcium oscillation in vivo at the individual cell level has long been impossible because of the SCN location. Moreover, its relationship with typical, neuronal activity-related brief calcium signals remained unclear. To address these questions, the researchers at IGF used state-of-the-art imaging to monitor cellular calcium with a miniaturized microscope in the SCN of freely moving mice. This approach unveils that fast calcium signals in SCN neurons are small in amplitude, and superimposed upon the daily oscillation in baseline calcium concentration. Remarkably, these two calcium dynamics are independently modulated with the time of day. The baseline calcium oscillates synchronously in all recorded neurons, supporting the temporal unity that confers precision to our circadian clock. Contrastingly, fast signals underscore the functional diversity among these same neurons, some being preferentially active during the day when their calcium concentration is high, others at night when calcium level is low. Hence, nested calcium dynamics, supporting cell unity in the course of hours and cell diversity at the timescale of seconds, expand the calcium code with many new combinations in clock cells.
More generally, this work published in PNAS Nexus illustrates how calcium signaling may individualize functional cell subsets in a coherent neural network, similar to the way players in a sports team fulfill specific roles while all wearing the same team colors.