VERS LE DÉVELOPPEMENT D’OPIOÏDES SANS EFFETS SECONDAIRES POUR LUTTER PLUS EFFICACEMENT CONTRE LA DOULEUR
Les effets secondaires des médicaments sont souvent dus à des interactions involontaires avec de mauvaises cibles dans notre organisme. Les médicaments modernes sont de plus en plus spécifiques à leurs cibles, grâce aux efforts considérables de la recherche pour réduire les effets secondaires. Toutefois, l'action des médicaments même sur leur cible, peut encore produire des effets secondaires, parfois graves. Ces dernières années par exemple, les analgésiques opioïdes ont causé plus de 70 000 décès aux États-Unis en 2019.
En Europe, une "épidémie silencieuse d'opioïdes" suscite également des inquiétudes. En effet, les opioïdes agissent sur nos récepteurs opioïdes, qui contrôlent non seulement la douleur, mais aussi la récompense, la dépendance, l'humeur et encore d'autres fonctions. Comme la plupart des cibles médicamenteuses (sinon toutes), les récepteurs opioïdes sont des dispositifs moléculaires multifonctionnels de taille nanométrique. Où se trouve donc le bouton spécifique anti-douleur sans effets secondaires ?
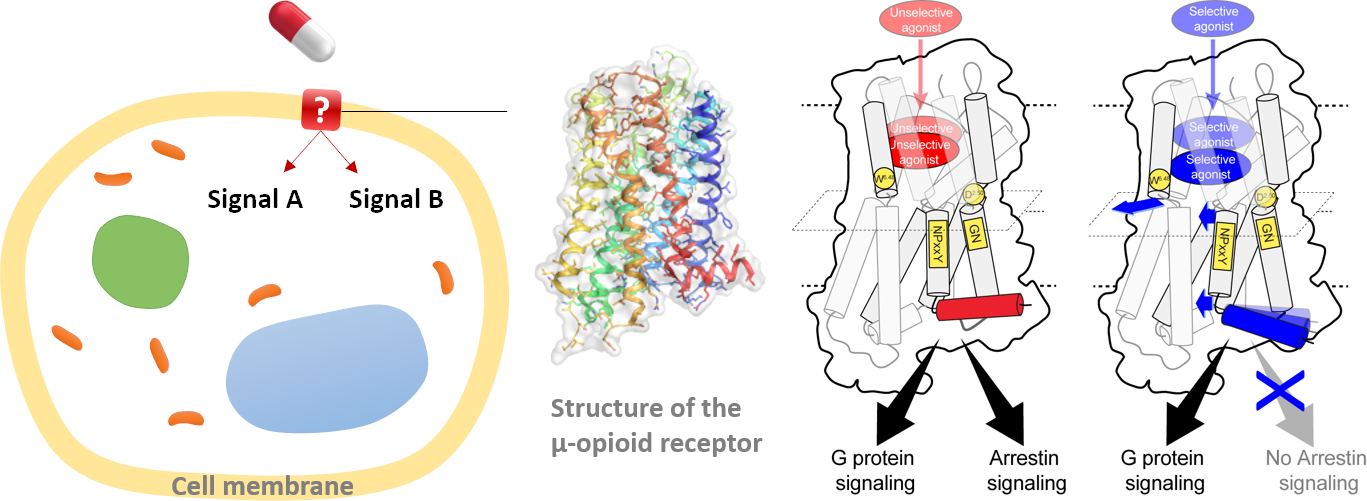
L’équipe du Dr Sébastien Granier au sein de l'Institut de génomique fonctionnelle vient de faire un grand pas vers cette réponse. Les récepteurs opioïdes sont des récepteurs couplés aux protéines G (RCPG). Les RCPG sont des protéines à la surface des cellules qui régulent les réponses cellulaires aux stimuli extracellulaires. Les humains possèdent 800 types de RCPG, qui contiennent les cibles de ~40% des médicaments commercialisés. Cette famille de protéines partage une architecture tridimensionnelle et deux principales voies de signalisation à l'intérieur des cellules. Sous l'effet de stimuli (par exemple, des molécules médicamenteuses), un RCPG peut adopter différentes conformations, qui ouvrent/ferment les voies de signalisation de manière spécifique pour déclencher différentes réponses cellulaires et réactions corporelles. La nature nous a donné des dispositifs aussi délicats, mais sans les manuels.
En 2012, le Dr Granier et ses collègues ont obtenu les premières structures 3D à haute résolution des récepteurs opioïdes. En 2015, son équipe a mis au point une stratégie permettant d’observer les changements de conformation du récepteur µ-opioïde pendant sa réponse aux analgésiques opioïdes. Cette année, l'équipe vient de découvrir comment différents analgésiques ouvrent/ferment séparément les deux principales voies du récepteur (et déclenchent des réponses cellulaires différentes), en agissant sur un point idéal au cœur du récepteur.
Ce travail, publié dans la revue Molecular Cell, combine des simulations informatiques (~2 mois de calculs sur l'un des supercalculateurs les plus rapides de France, OCCIGEN), la spectroscopie RMN et des essais de pharmacologie sur cellules vivantes. Elle décrit le mécanisme de ce nanodispositif dans les moindres détails.
Pour voir une présentation 3D, cliquez ici. L'équipe cherche maintenant à savoir si ce mécanisme est universel pour d'autres RCPG. La compréhension de plus en plus précise de ces cibles permettra de futurs médicaments de plus en plus spécifiques.
Lien publication : Molecular insights into the biased signalling mechanism of the m-opioid receptor (Molecular Cell, septembre 2021)
On en parle dans la presse :
- Communiqué de Presse Inserm : 7/09/2021
- LE FIGARO santé : 20/09/2021
- Vidéo "Biased signaling mechanism of the mu-opioid receptor" sur ce lien
- Pour la Science sur ce lien
- EURACTIV sur ce lien
- UNIVADIS sur ce lien
- [Podcast] A LUM LA SCIENCE #2 : Des opioïdes sans effets secondaires à la plateforme d’expérimentation en économie
....................................................................................................................................................................................................................................................................................................................................................................................
Drug side effects are often due to unintended interactions with our body besides the target site. Modern drugs are becoming more specific for their targets, thanks to the tremendous research efforts in reducing side effects. However, on-target drug actions may still produce side effects, sometimes severe adverse ones. Opioid painkillers, for instance, caused over 70,000 deaths in the US in 2019. In Europe, a “silent opioid epidemic” is also raising concerns. This is because opioids act on our opioid receptors, which control not only pain, but also reward, addiction, mood and other functions. Like most (if not all) drug targets, opioid receptors are nanosized multifunctional molecular devices. Where is the right button for painkilling?
Dr. Sebastien Granier and his team in the Institute of Functional Genomics just made a big step toward the answer. Opioid receptors are G protein-coupled receptors (GPCRS). GPCRs are proteins on the cell surface that regulate cellular responses to extracellular stimuli. Humans have 800 types of GPCRs, which contain the targets of ~40% of marketed drugs. Most of them have similar shapes and two main output “ports” (signaling pathways) toward the interior of cells. Driven by the stimuli (e.g. drug molecules), a GPCR can change to different conformations, which open/close the ports in specific ways to trigger different cellular responses and body reactions. How to design drugs that Nature has given us such delicate devices, however, without the manual books.
In 2012, Dr. Granier and his colleagues obtained the first high-resolution 3D structures of opioid receptors. In 2015, his team developed a strategy to probe the conformational changes in the µ-opioid receptor during its response to opioid painkillers. This year, the team has just discovered how different opioid painkillers open/close the two ports of the receptor separately (and trigger different cellular responses), by pressing a sweet spot in the receptor’s heart. This work, published in the Molecular Cell journal, combined computer simulations (~2 months of calculations on one of France's fastest supercomputers, OCCIGEN), NMR spectroscopy and live-cell pharmacology assays. It describes the mechanism of this nanodevice in atomistic detail. To see a 3D presentation, click here. The team is now investigating whether the mechanism is universal for other GPCRs. Future drugs will be more and more precise, as we understand better and better their targets.