
TO PEE OR NOT TO PEE : COMMENT LA VASOPRESSINE PERMET-ELLE DE RÉGULER NOTRE ÉQUILIBRE HYDRIQUE ?
L’arginine vasopressine (AVP) est l’hormone antidiurétique, et elle régule une fonction vitale de notre organisme, l’équilibre hydrique. Elle agit au niveau du rein, plus précisément à la membrane plasmique des cellules principales du tubule collecteur, segment distal du néphron. C’est par son interaction avec le récepteur V2 (V2R), protéine membranaire de la famille des récepteurs couplés aux protéines G (RCPGs), que cette hormone peptidique active une voie de signalisation cellulaire qui conduit à une relocalisation des canaux à eau, les aquaporines, et donc à la réabsorption de l’eau de l’urine vers le sang. Le couplage du récepteur V2 à la protéine Gs constitue une étape clé de cette voie de signalisation.
Mais comment ça marche ?
C'est ce que vient de déterminer l’équipe de Bernard Mouillac et Sébastien Granier à l’Institut de Génomique Fonctionnelle (IGF), en collaboration avec l’équipe de Patrick Bron au Centre de de Biologie Structurale (CBS) par une approche de cryo-microscopie électronique. La stratégie des chercheurs combine également des données de RMN (résonance magnétique nucléaire) déterminées par Hélène Déméné (CBS) et des approches computationnelles de dynamique moléculaire développées par Nicolas Floquet à l’Institut des Biomolécules Max Mousseron (IBMM). C’est donc un travail 100% montpelliérain.
Cette approche intégrée de biologie structurale a permis de déterminer dans les moindres détails moléculaires comment l'AVP se fixe sur le récepteur pour activer la protéine Gs. La structure 3D du complexe ternaire composé de l’hormone naturelle, du récepteur V2 et de la protéine Gs n’avait encore jamais été déterminée expérimentalement.
Cette étude va plus loin que la simple description d’une structure d’un récepteur ou d’un complexe de signalisation. En effet, de nombreuses mutations du récepteur sont responsables de deux maladies génétiques rares présentant un tableau clinique inversé : 1/ le diabète insipide néphrogénique congénital (DINc) dû à des mutations « perte de fonction » associées à une incapacité des patients à concentrer leurs urines, 2/ le syndrome néphrogénique d’antidiurèse inappropriée (SNADI) lié à des mutations constitutivement actives caractérisé par une intoxication à l’eau et une hyponatrémie. Le V2R est également une cible primordiale pour traiter certaines formes de polykystose rénale, maladie beaucoup plus fréquente menant en général à une insuffisance rénale. Vis-à-vis de ces différentes pathologies, il y a donc un intérêt tout particulier à développer des outils thérapeutiques du V2R présentant une meilleure sélectivité, une meilleure efficacité, sans entraîner d’effets indésirables.
L'étude permet plus particulièrement de proposer d’un point de vue structural les conséquences de mutations ponctuelles du V2R. Par exemple, les chercheurs avancent des hypothèses pour expliquer pourquoi les mutants de l’acide aminé arginine 137 en leucine ou cystéine (R137L ou R137C) provoquent une activation constitutive du V2R et donc la maladie SNADI. Il est également tentant d’interpréter des observations cliniques, ou des données cellulaires et pharmacologiques in vitro sur la base des informations structurales du V2R. Par exemple, des hypothèses sont proposées pour expliquer les conséquences des mutations V88M (valine mutée en méthionine) ou M272R (méthionine mutée en arginine) responsables d’un DINc.
A l’avenir, la connaissance des détails atomiques des différentes conformations du récepteur V2 guidera le développement de nouvelles molécules thérapeutiques pour l’activer ou le bloquer. Cette perspective de recherche est cruciale vis-à-vis de maladies difficiles à gérer et accablantes pour les patients.
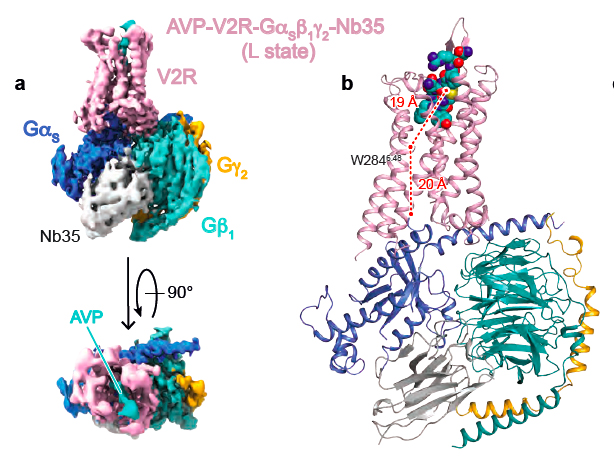
Carte de densité du complexe de signalisation AVP-V2R-Gs (A) et modèle 3D correspondant (B)
Cryo-electron microscopy structure of the antidiuretic hormone arginine-vasopressin V2 receptor signaling complex.
J. Bous, H. Orcel, N. Floquet, C. Leyrat, J. Lai-Kee-Him, G. Gaibelet, A. Ancelin, J. Saint-Paul, S. Trapani, M. Louet, R. Sounier, H. Déméné, S. Granier, P. Bron, B. Mouillac.Science Advances, 7, eabg5628 (2021).
...................................................................................................................................................................................................................................................
To pee or not to pee: how the vasopressin hormone regulates our body water balance ?
Arginine-vasopressin (AVP) is known as the antidiuretic hormone, and it regulates a vital function of our body, water homeostasis. It plays a role in the kidney at the basolateral membranes of the principal cells of the distal collecting duct of the nephron where it directly interacts with the V2 receptor subtype (V2R), which is a typical G protein-coupled receptor (RCPGs). Upon interaction, AVP activates a signaling pathway leading to fusion of aquaporine water channels to the apical membrane of the cells and consequently to water reabsorption from urine to blood. Coupling of the V2R to the Gs protein constitutes a first key step of the cellular response.
But how does it work at a molecular level?
This is what was very recently determined by the team of Bernard Mouillac and Sébastien Granier at the Institut de Génomique Fonctionnelle (IGF), in collaboration with the team of Patrick Bron from the Centre de Biologie Structurale (CBS) using a cryo-electron microscopy approach. The strategy of the researchers also combines experimental NMR (Nuclear Magnetic Resonance) data obtained by Hélène Déméné (CBS) and computational molecular dynamic simulations developed by Nicolas Floquet at the Institut des Biomolécules Max Mousseron (IBMM). This work is 100% done in Montpellier.
This structural biology hybrid approach allowed to solve molecular details of AVP binding to V2R and of the interface of the receptor with the Gs protein signaling partner. Interestingly, the 3D structure of the AVP-V2R-Gs ternary complex had never been defined from an experimental point of view, and represents a real breakthrough.
This study goes further than a simple description of a receptor or a signaling protein complex structure. Indeed, many single mutations of the V2R are responsible for two rare genetic diseases with opposite clinical outcomes: 1/ the congenital Nephrogenic Diabetes Insipidus (cNDI) associated to loss-of-function mutations leading people suffering for this pathology to be unable to concentrate their urine, 2/ the Nephrogenic Syndrome of Inappropriate antidiuresis (NSIAD) linked to constitutive active mutations and characterized by water loading and hyponatremia. V2R is also a major therapeutic target for treating autosomal dominant polycystic kidney disease, a much more frequent pathology which leads in most of the cases to renal failure. Towards these different diseases, there is a real interest in the development of novel V2R « drugs » displaying a better selectivity, a better potency, with no adverse effects.
In particular, the study gives structural hypotheses that may explain consequences of several V2R mutations. For instance, the researchers propose an explanation to link mutants of the amino-acid residue arginine 137 into leucine or cysteine (R137L or R137C) and constitutive activity responsible for NSIAD. It is also tempting to interpret cNDI clinical observations or in vitro pharmacological and cellular data based on the present structure of the V2R. For instance, hypotheses are proposed to explain structural consequences of mutations V88M (valine mutated into methionine) or M272R (methionine mutated into arginine) that are responsible for V2R loss-of-function.
In the future, the knowledge of molecular details of the different conformations of the V2 receptor will guide development of new therapeutic molecules able to activate or to inhibit its function. This research perspective is crucial regarding patients who are suffering for these pathologies which are difficult to manage.

Density map of the AVP-V2R-Gs signaling complex (A) and its corresponding 3D model (B)
Cryo-electron microscopy structure of the antidiuretic hormone arginine-vasopressin V2 receptor signaling complex.
J. Bous, H. Orcel, N. Floquet, C. Leyrat, J. Lai-Kee-Him, G. Gaibelet, A. Ancelin, J. Saint-Paul, S. Trapani, M. Louet, R. Sounier, H. Déméné, S. Granier, P. Bron, B. Mouillac.Science Advances, 7, eabg5628 (2021).





