OPTIMISATION DE LA RECHERCHE DES CELLULES BETA DURANT LE DIABÈTE : DES ROUTES PRINCIPALES POUR LES CELLULES IMMUNES
En imageant directement in vivo la dynamique des cellules immunitaires dans le pancréas durant le développement du diabète de type 1 dans un modèle murin, Marie Schaeffer, chercheuse dans l’équipe de Patrice Mollard à l’Institut de Génomique Fonctionnelle de Montpellier, et son collaborateur Javier Hernandez à l’Institut de médecine régénératrice et immunothérapie de Montpellier, ont identifié un mécanisme moléculaire permettant d’optimiser la rencontre entre cellules immunitaires et les cellules beta durant diabète de type 1. Cette étude a été acceptée en mai 2018 dans la revue Frontiers in Immunology.
Le diabète de type 1 est une maladie autoimmune caractérisée par une infiltration du pancréas par les cellules immunitaires et la destruction des cellules beta productrices d’insuline. Comment les lymphocytes, acteurs principaux de cette attaque, sont capables de trouver efficacement leurs cellules cibles regroupées en îlots dispersés dans le pancréas reste largement inexploré.
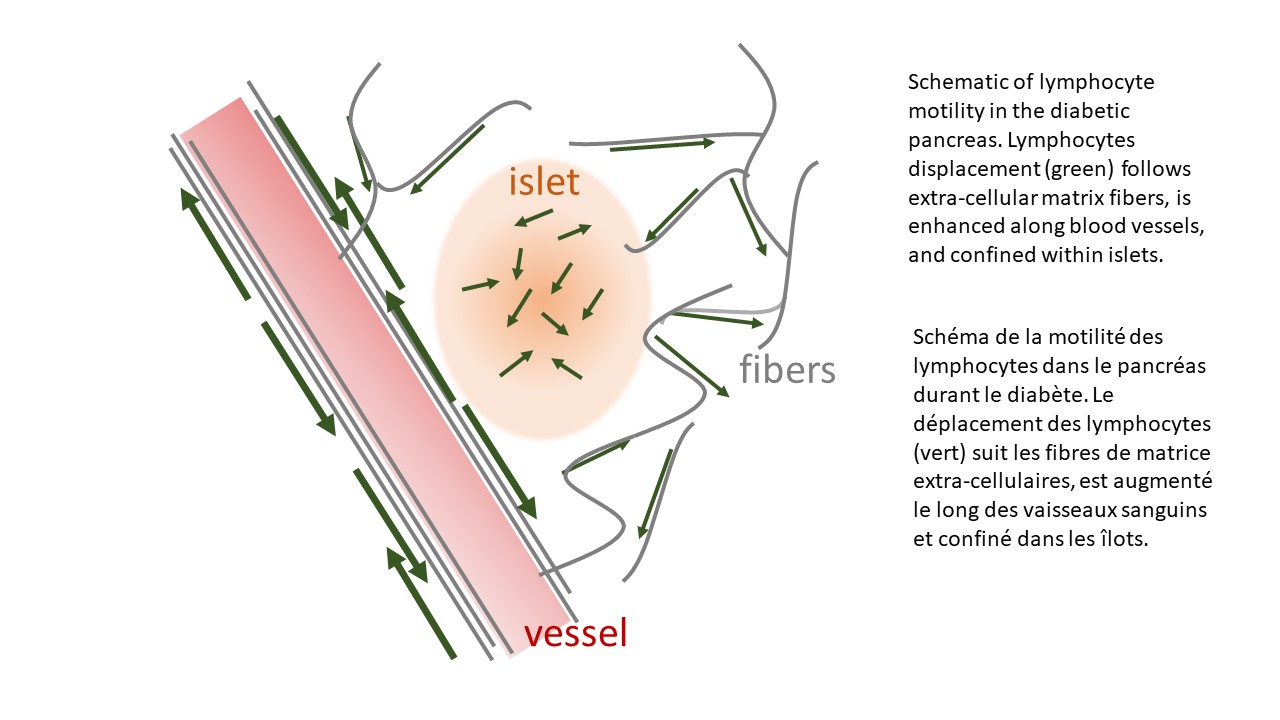
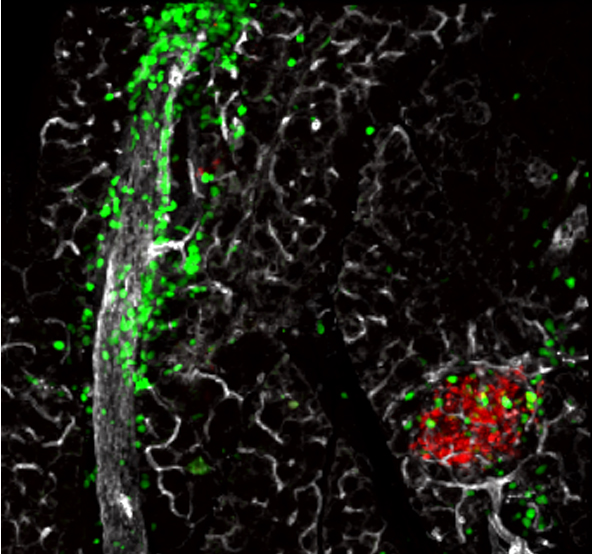
En utilisant la microscopie multi-photonique intra-vitale appliquée au pancréas chez la souris anesthésiée, dans un modèle de souris diabétiques aux cellules immunitaires identifiées par des marqueurs fluorescents, les chercheurs ont pu visualiser les lymphocytes et quantifier leurs dynamiques migratoires in vivo durant le développement de la maladie. D’une part, les îlots ne semblent pas attirer les cellules immunes. En revanche, des chimiokines permettent de confiner les lymphocytes à l’intérieur des îlots. D’autre part, en dehors des îlots, la vitesse et la directionalité de déplacement des lymphocytes est augmentée le long des vaisseaux sanguins et des fibres de matrice extra-cellulaires. Cette migration privilégiée implique des interactions moléculaires entre ces fibres et les lymphocytes, par le biais d’intégrines. En utilisant des anticorps bloquants ces interactions, le déplacement des lymphocytes est ralenti et les fonctions effectrices des lymphocytes sont diminuées.
Les chercheurs ont ainsi démontré un rôle important des interactions entre lymphocytes et leur milieu dans l’optimisation de la recherche de leurs cellules cibles et le maintien des fonctions effectrices des lymphocytes dans le pancréas durant le diabète pouvant avoir une grande importance dans le développement de nouvelles thérapies contre le diabète de type 1.
AUTOIMMUNE CELL ENCOUNTER WITH BETA CELLS DURING DIABETES: HIGHWAYS TO ISLETS
Using in vivo imaging of immune cell dynamics in the pancreas during type 1 diabetes in a mouse model, Marie Schaeffer, researcher in Patrice Mollard’s team at the Institute of Functional Genomics in Montpellier, and her collaborator Javier Hernandez at the Institute of Regenerative Medicine and Immunotherapy in Montpellier, identified a key molecular mechanism involved in the optimization immune cell-beta cell encounter during type 1 diabetes development. This study was accepted in mai 2018 in the journal Frontiers in Immunology.
Type 1 diabetes is an autoimmune disease characterized by an infiltration of the pancreas by immune cells and destruction of insulin-producing beta cells. How lymphocytes, which play a key role in this process, efficiently encounter their target cells grouped in islets dispersed throughout the pancreas, remained largely unexplored.
Using intra-vital multi-photon microscopy applied to the pancreas of anesthetized mice in a mouse model of diabetes where immune cells were labeled with fluorescent proteins, the researchers were able to visualize both lymphocyte populations and quantify their dynamics of migration in vivo during disease onset. First, islets are unable to attract lymphocytes. However, chemokines are able to confine lymphocytes within islets to promote their accumulation at target sites. Second, outside islets, lymphocytes velocity and directionality is enhanced along blood vessels and extra-cellular matrix fibers. This guided motility implicates integrin-dependent molecular interactions between these fibers and lymphocytes. Using antibodies blocking these interactions, lymphocyte migration is impaired and lymphocyte effector functions are decreased.
The researchers thus demonstrated a pivotal role for interactions between lymphocytes and their environment in optimization of target cell encounter and maintenance of effector functions of lymphocytes in the pancreas that may have important implications for the design of new therapeutic strategies against diabetes.