UN NOUVEAU MÉCANISME DE SIGNALISATION DES Β-ARRESTINES
L’équipe de Philippe Marin « Neuroprotéomique et Signalisation des Maladies Neurologiques et Psychiatriques » en collaboration avec l’équipe BIOS (Biologie et bioinformatique des systèmes de signalisation) de l’INRA de Nouzilly a mis en évidence un nouveau mécanisme de signalisation de la β-arrestine 2. Ce travail, publié dans la revue Elife , décrit une phosphorylation de la β-arrestine 2 sur la Thréonine 383 par la kinase MEK qui est spécifiquement mis en jeu lors de l’activation β-arrestine dépendante de la voie de signalisation Erk par les récepteurs couplés aux protéines G (RCPG).
Des expériences de transfert d’énergie par résonance (BRET) intramoléculaire et de mutagenèse dirigée ont montré que cette phosphorylation est nécessaire à un changement de conformation de la β-arrestine 2 et au recrutement d’Erk par l’arrestine. Des expériences de docking moléculaire indiquent que ce changement de conformation permet de libérer l’espace nécessaire au recrutement d’Erk par l’arrestine.
Ce mécanisme semble généralisable puisque l’ensemble des RCPG testés qui activent Erk via les β-arrestines induisent cette phosphorylation alors que les RCPG qui activent Erk par un mécanisme indépendant des β-arrestines en sont incapables. Il constitue un nouveau mécanisme par lequel les β-arrestines intègrent de nombreux signaux extracellulaires et régulent finement les voies de signalisation qu’elles déclenchent. Le nouvel anticorps reconnaissant spécifiquement la béta arrestine 2 phosphorylée sur la Thr383 développé en collaboration avec la société Cisbio Bioassays (Codolet, France) devrait permettre de suivre l’activation β-arrestine dépendante de la voie Erk, potentiellement in vivo, et ainsi de cribler de nombreuses molécules ciblant les RCPG et la signalisation dépendante des β-arrestines.
Phosphorylation of β-arrestin 2 at Thr383 by MEK underlies β-arrestin-dependent activation of Erk1/2 by GPCRs. Cassier E, Gallay N, Bourquard T, Claeysen S, Bockaert J, Crépieux P, Poupon A, Reiter E, Marin P, Vandermoere F. Elife. 2017 Feb 7;6. pii: e23777. doi: 10.7554/eLife.23777.
Ce projet a été financé par la Fondation pour la Recherche Médicale (Equipe FRM 2009), l’Agence nationale de la recherche (Contrat ANR-2011-1619 01), le CNRS, l’INSERM, l’Université de Montpellier, INRA et l’Université de Tours.

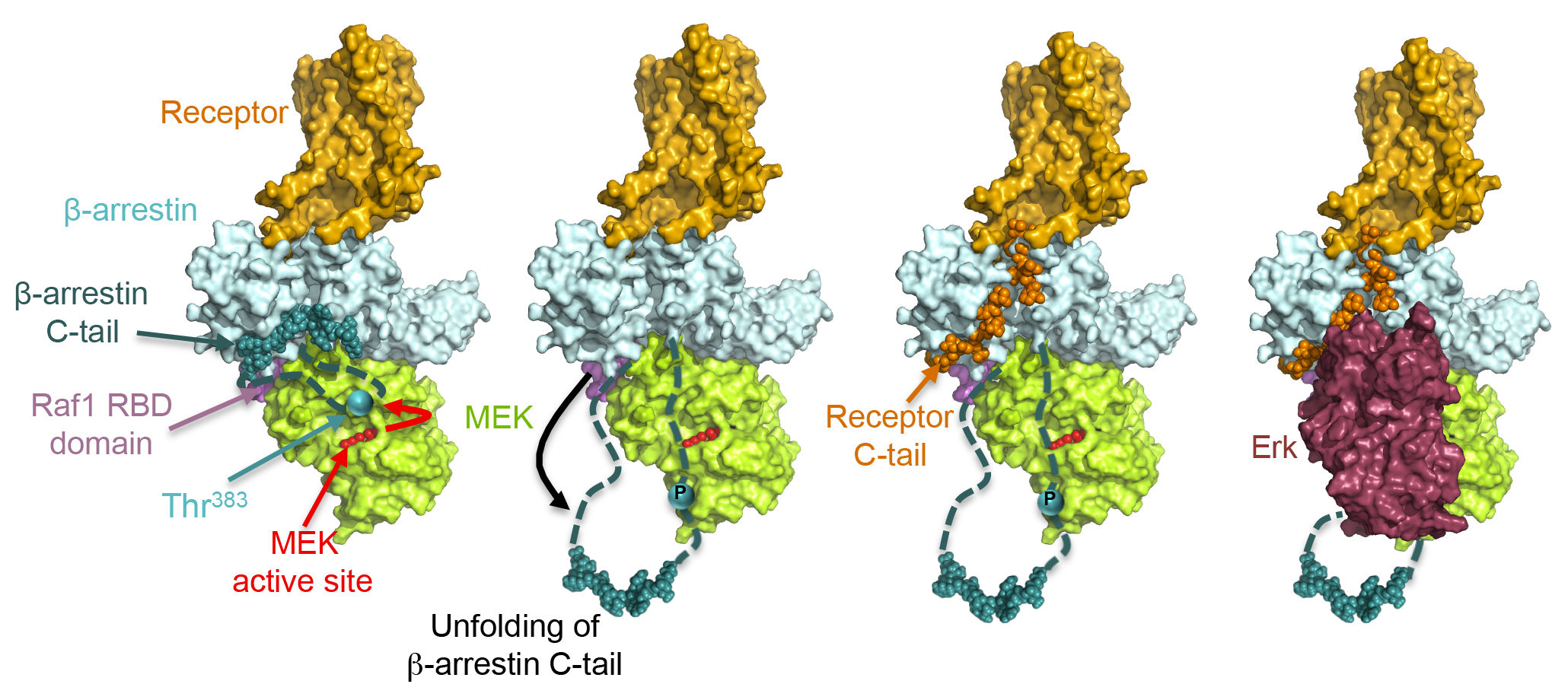
Nouveau mécanisme de signalisation de la β-arrestine 2 par phosphorylation de la Thr383:
La β-arrestine 2 recrutée au récepteur porte déjà la kinase MEK.
La stimulation du récepteur induit la phosphorylation de la β-arrestine 2 sur la Thr383 par MEK.
Cette phosphorylation provoque un changement de conformation de la β-arrestine 2 qui libère l’espace pour le recrutement d’Erk par la β-arrestine 2. Erk est à son tour phosphorylé par MEK et donc activé.







