PIRATAGE DE NOS CELLULES PAR LE STAPHYLOCOQUE DORÉ: RÉCEPTEURS MEMBRANAIRES ET TOXINES BACTÉRIENNES À LA LOUPE
La résistance antimicrobienne du staphylocoque doré (Staphylococcus aureus, SA) représente une grande menace pour la santé publique. De nouvelles cibles thérapeutiques sont donc nécessaires pour la conception d'antibiotiques innovants. Les leukotoxines secrétées par SA sont des cibles intéressantes car elles se lient aux récepteurs de l’hôte, notamment aux récepteurs des chimiokines présents à la surface des cellules immunitaires et érythrocytaires, une étape critique dans la pathogénicité de SA. En effet, cette liaison conduit à la destruction de ces cellules, ce qui permet au SA de diminuer la capacité de l'hôte à se débarrasser du pathogène et en même temps de fournir les éléments essentiels à la croissance bactérienne, notamment le fer présent dans les érythrocytes.
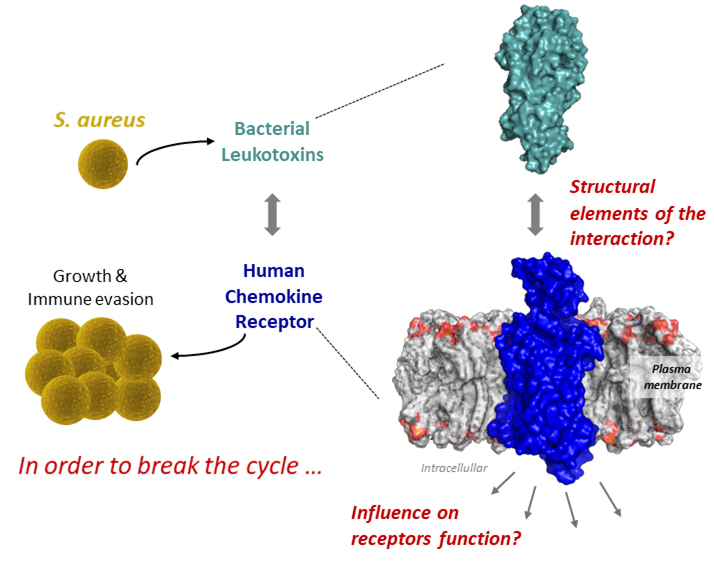
Pour mieux comprendre comment ces toxines agissent sur leur cible, l'équipe de Sébastien Granier à l’Institut de Génomique Fonctionnelle (CNRS/INSERM/Université de Montpellier), dans une étude co-dirigée par Chérine Bechara, a développé une approche intégrative de pharmacologie et de spectrométrie de masse structurale. Plus particulièrement, ce travail publié dans la revue PNAS, décrit les mécanismes moléculaires de la liaison toxine/récepteur et son effet sur les conformations du récepteur, c'est à dire comment la toxine modifie la structure du récepteur pour pirater son activité.
Cette étude constitue donc une première étape vers le développement d'antibiotiques innovants qui bloqueraient le pouvoir pathogène de SA en inhibant la liaison aux récepteurs de l’hôte.
 Structure and function of leukotoxin/receptor complexes:
Structure and function of leukotoxin/receptor complexes:
a new therapeutic window to inhibitSA infection
.................................................................................................................................................................................................................................................................................................................................................................................
HOW DOES STAPHYLOCOCCUS AUREUS HIJACK OUR IMMUNE SYSTEM? MEMBRANE RECEPTORS AND BACTERIAL TOXINS AT PLAY
The rise of multidrug resistant strains of Staphylococcus aureus (SA) represents a major threat to public health. To combat resistant strains, we urgently need to target novel molecular mechanisms essential for SA growth and pathogenesis. One such essential mechanism is bacterial leukotoxins secreted by SA that binds to host receptors, mainly host chemokine receptors present at the surface of myeloid and erythroid cells, leading to
In order to understand how these toxins influence their targeted receptor, the team of Sébastien Granier at the Institute of Functional Genomics (CNRS/INSERM/University of Montpellier), in a study co-directed by Chérine Bechara, developed an innovative integrative approach of pharmacology and structural mass spectrometry. This work published in PNAS, describes the molecular mechanisms of toxin/receptor binding and the effects on receptor’s conformation, revealing therefore how the toxins modifies the structure of the receptor to hijack its activity.
This study constitutes the first step towards the development of novel inhibitors to tackle SA growth and virulence by blocking toxins binding to host receptors.





