FITNESS MITOCHONDRIAL
Le coût énergétique du stress n’est pas tenable sans plasticité cellulaire. Les mitochondries ont la capacité de limiter les dépenses cellulaires on restreignant la communication intercellulaire. Les neurones par exemple, utilisent leurs mitochondries pour détruire des synapses et se préserver des dommages du stress. Une équipe de l’IGF avec l’aide de collaborateurs internationaux publient une étude dans The Journal of Neuroscience identifiant un mécanisme génétique protecteur contre les dommages du stress par l’adaptation entre mitochondries et synapses. Ce mécanisme est perturbé dans les neurones du cortex préfrontal de souris exposées à un stress chronique et dans le cortex préfrontal humain de patients affectés par la dépression et la maladie d’Alzheimer.
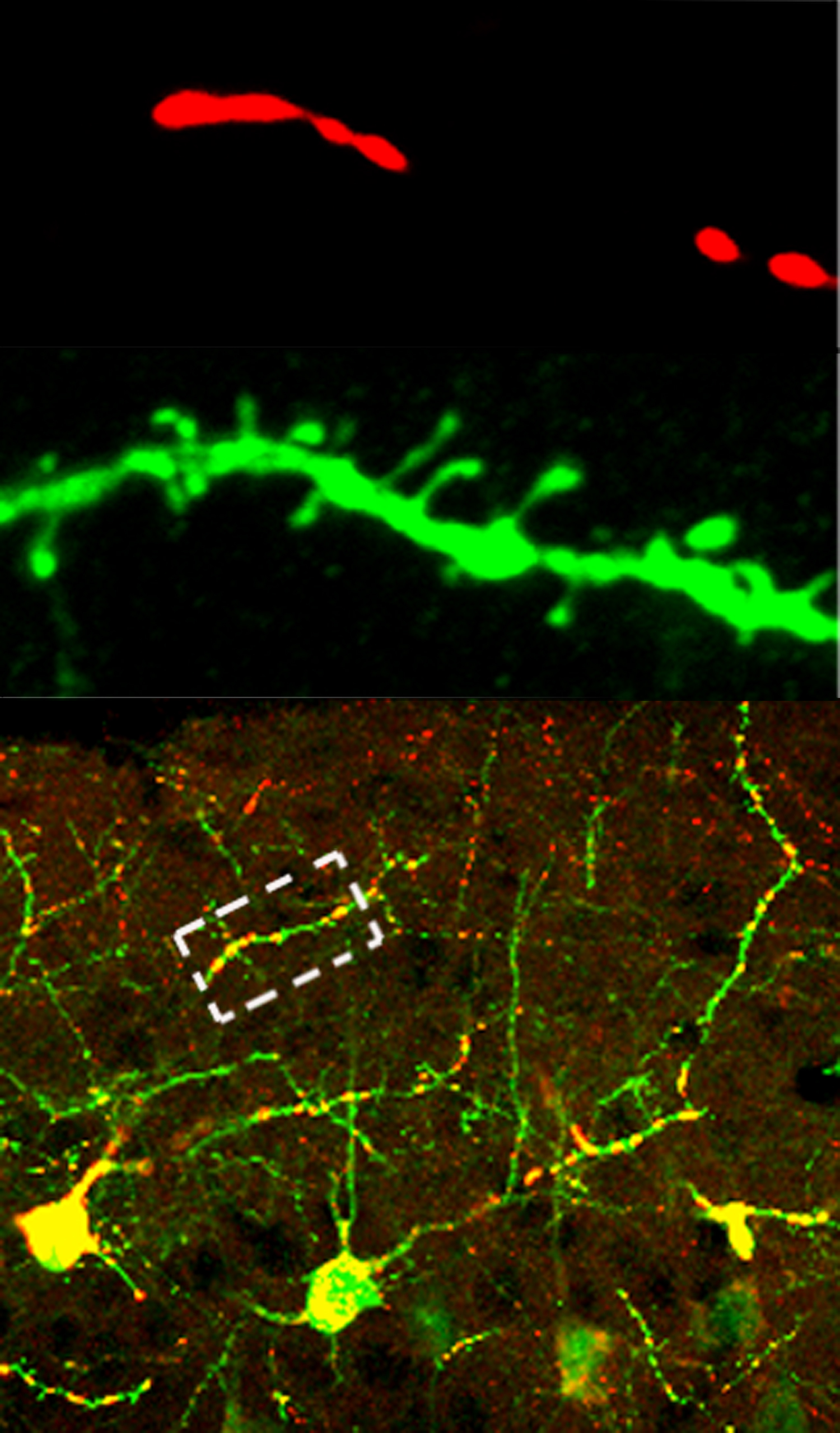
Le cerveau a une consommation énergétique soutenue et des capacités de réserve limitées. Plus l’activité neuronale augmente, plus le coût énergique est élevé. Pourtant un épuisement métabolique dans le cerveau est peu probable puisque les mitochondries fabriquent constamment les ressources nécessaires à son fonctionnement. Mais plus le rendement augmente et plus les déchets mitochondriaux peuvent devenir toxiques, en s’accumulant. La survie des neurones dépend donc de la gestion du budget énergétique. L’équipe du Dr. Arango-Lievano (Freddy Jeanneteau) à l’institut de génomique fonctionnelle de Montpellier a postulée que des points de contrôles moléculaires doivent permettre de faire le lien entre l’état d’activité synaptique et l’état d’activité mitochondriale.
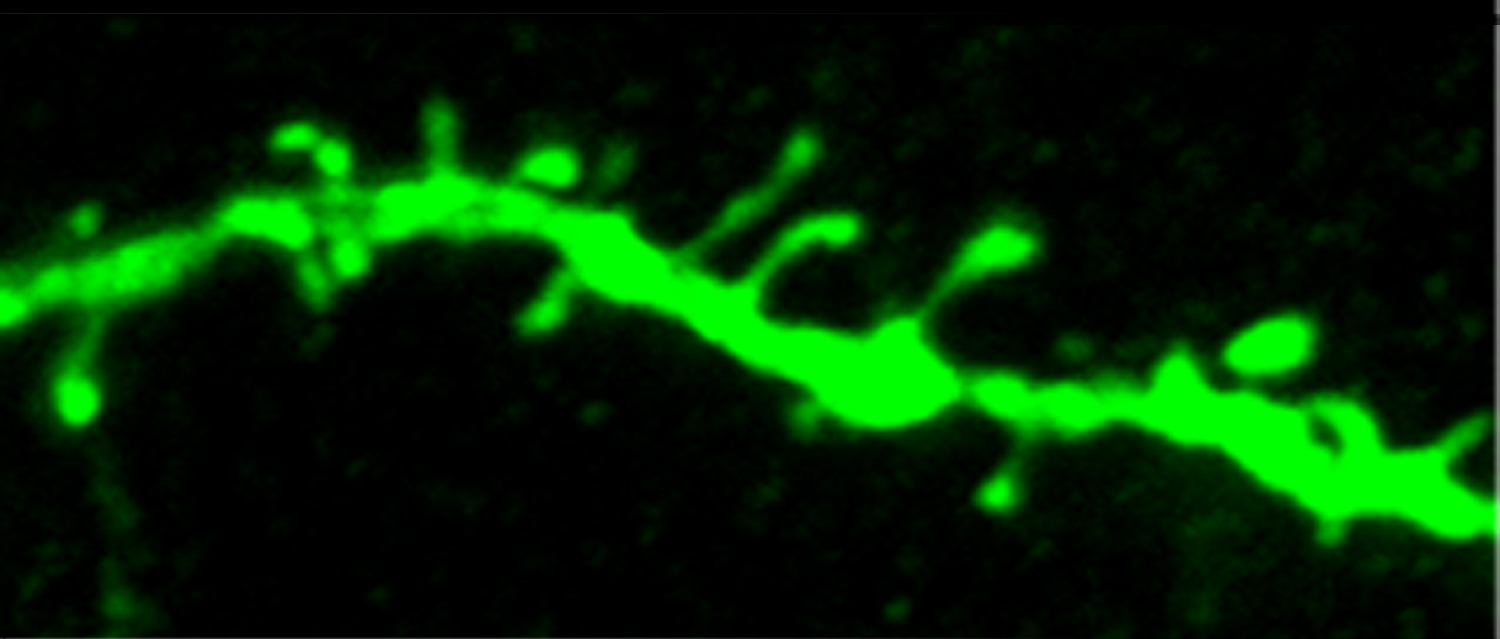
Ils ont découvert un facteur de transcription, NR4A1, qui permet d’ajuster le nombre de synapses par rapport à la compétence énergétique des mitochondries. En tant que gène de réponse immédiate, NR4A1 facilite la plasticité synaptique mais son expression ou activité, prolongée, peuvent être préjudiciables. C’est le cas du stress psychologique qui utilise NR4A1 pour découpler le rendement énergétique mitochondrial de la maintenance des synapses. La répétition du stress joue sur ce levier mitochondrial pour modifier le nombre des synapses dans des neurones pyramidaux du cortex préfrontal particulièrement sensibles à l’excitotoxicité. Le résultat est que les mitochondries ont la capacité de gérer les dépenses cellulaires en limitant les frais de communication intercellulaire. Cela signifie que l’attrition synaptique du cortex préfrontal suite à un stress chronique est adaptative. Les chercheurs ont ensuite transposé ce résultat fondamental à des neuropathologies humaines dont la progression est sensible au stress chronique. L’expression et l’activité de NR4A1 sont anormales dans le cortex préfrontal de malades atteint de dépression majeure et de la maladie d’Alzheimer. Ces résultats ouvrent la porte à des études complémentaires pour activer le levier de l’adaptation cellulaire au stress par l’intermédiaire du fitness mitochondrial.
Communication entre synapses et mitochondries
Liens Publication :
The stress-induced transcription factor NR4A1 adjusts mitochondrial function and synapse number in prefrontal cortex
Jeanneteau Freddy, Barrère Christian, Vos Mariska, De Vries Carlie, Rouillard Claude, Levesque, Daniel, Dromard Yann, Moisan Marie-Pierre, Duric, Vanja, Franklin Tina, Duman Ronald, Lewis David, Ginsberg Stephen and Arango-Lievano Margarita
The Journal of Neuroscience
STRESS GENE REGULATES BRAIN CELL POWER AND CONNECTIONS IN RODENTS
A gene activated by stress adjusts energy output and synapse number of prefrontal cortex neurons, finds a study of male mice and rats published in JNeurosci. The results were validated in brain tissue of deceased patients with Alzheimer's disease and depression, two disorders known to be aggravated by stress.
Margarita Arango-Lievano, Freddy Jeanneteau and colleagues found that the gene NR4A1 is involved in regulating mitochondria, the cellular powerhouse, of PFC neurons in response to stress. This may help conserve the cells' energy in the context of immediate stress when demand is high. However, excessive activity of this gene during chronic stress may interfere with the normal functioning of circuits between the PFC and the rest of the brain through its impact on connectivity of individual cells. The researchers show that altering the expression of NR4A1 in animals exposed to chronic stressors protects PFC cells from synaptic loss. This gene may therefore represent a target to explore in future studies of stress-related disorders.